题目内容
14.下列物质中,不属于电解质的是( )| A. | NaOH | B. | H2SO4 | C. | 蔗糖 | D. | KCl |
分析 电解质在熔融状态或水溶液中能导电的化合物,非电解质是在熔融状态和水溶液中都不能导电的化合物.
解答 解:A、NaOH为强碱,属于电解质,故A错误;
B、H2SO4为强酸,属于强电解质,故B错误;
C、蔗糖不能电离,属于非电解质,故C正确;
D、KCl为盐,属于强电解质,故D错误,故选C.
点评 本题考查电解质和非电解质的概念,题目难度不大,注意相关概念的理解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2含有的原子数为NA | |
| B. | 等质量的O2和O3中所含的氧原子数相等 | |
| C. | 同温同压下,相同体积的H2和O2,其质量比为1:16 | |
| D. | 28g CO与22.4L CO2所含的碳原子数相等 |
9.取两份质量相同的小苏打,一份直接与稀盐酸反应,另一份先加热至恒重,再与稀盐酸反应,下列说法正确的是( )
| A. | 消耗相同浓度的盐酸一样多 | |
| B. | 消耗同浓度的盐酸后者多 | |
| C. | 与盐酸反应后相同条件下收集的气体一样多(不包括加热生成的) | |
| D. | 与盐酸反应后相同条件下收集的气体后者多.(不包括加热生成的) |
19.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 5.6 g Fe 和足量的HCl完全反应失去电子数为0.3 NA | |
| B. | 22.4L O2含有NA个O2分子 | |
| C. | 0.2 mol/L CaCl2溶液中含有Clˉ离子的数目为0.4NA | |
| D. | 1.6g CH4所含的电子数为NA |
6.以煤为原料,经化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
(1)将水蒸气通过红热的碳即可产生水煤气.
反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1;
①该反应在高温下能自发进行(填“能”或“不能”);
②恒温下,在容积不变的密闭容器中,进行如上可逆反应.一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:D.
Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量;ⅣCO物质的量浓度
A、只有ⅣB、只有Ⅰ和ⅣC、只有Ⅱ和ⅢD、Ⅰ、Ⅱ、Ⅲ和Ⅳ
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=4/9.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是C.
A、反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B、平衡时,甲中和丙中H2的转化率均是60%
C、平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D、平衡时,乙中CO2的转化率大于60%
(1)将水蒸气通过红热的碳即可产生水煤气.
反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1;
①该反应在高温下能自发进行(填“能”或“不能”);
②恒温下,在容积不变的密闭容器中,进行如上可逆反应.一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:D.
Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量;ⅣCO物质的量浓度
A、只有ⅣB、只有Ⅰ和ⅣC、只有Ⅱ和ⅢD、Ⅰ、Ⅱ、Ⅲ和Ⅳ
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=4/9.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是C.
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
B、平衡时,甲中和丙中H2的转化率均是60%
C、平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D、平衡时,乙中CO2的转化率大于60%
4.对于可逆反应C(s)+H2O(g)?CO(g)+H2(g),下列说法不能证明反应已达平衡状态的是( )
| A. | 绝热容器,温度不再改变 | |
| B. | 恒容时,压强不在改变 | |
| C. | 恒压时,体积不在改变 | |
| D. | 断裂2 mol O-H键同时形成1molH-H键 |
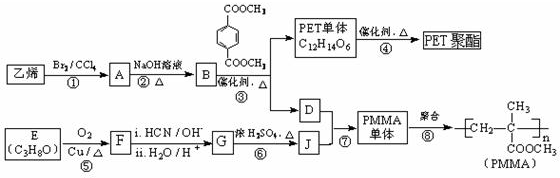
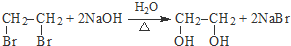 .
.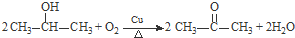 .
.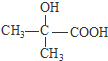 .
. 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH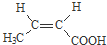 .
. .
.
 ;
;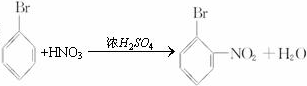 ;
; 、
、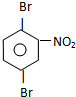 .
. 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.
吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.