题目内容
6.以煤为原料,经化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.(1)将水蒸气通过红热的碳即可产生水煤气.
反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1;
①该反应在高温下能自发进行(填“能”或“不能”);
②恒温下,在容积不变的密闭容器中,进行如上可逆反应.一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:D.
Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量;ⅣCO物质的量浓度
A、只有ⅣB、只有Ⅰ和ⅣC、只有Ⅱ和ⅢD、Ⅰ、Ⅱ、Ⅲ和Ⅳ
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=4/9.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是C.
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
B、平衡时,甲中和丙中H2的转化率均是60%
C、平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D、平衡时,乙中CO2的转化率大于60%
分析 (1)①该反应为熵增大,焓增大的反应,由△G=△H-T△S判断;
②根据达到平衡时的特征“等”、“定”结合反应方程式的特征判断是否达到平衡状态;
(2)反应H2O(g)+CO(g)?H(g)+CO2(g)中,反应物和生成物的体积相等,压强对平衡移动无影响,从等效平衡的角度结合浓度对平衡的影响分析.
解答 解:(1)①该反应为熵增大,焓增大的反应,由△G=△H-T△S,△G<0反应可自发进行,可知该反应在高温时可以自发进行,常温下难以自发进行,故答案为:能;
②Ⅰ由于有固体参加反应,当混合气体的密度不变时,气体的质量不变,说明达到平衡状态;
Ⅱ反应前后气体的体积不等,当容器内气体的压强不变时说明达到平衡状态;
Ⅲ反应前后气体的体积不等,混合气体的总物质的量不变,说明达到平衡状态;
ⅣCO物质的量浓度不变,说明达到平衡状态,则Ⅰ、Ⅱ、Ⅲ和Ⅳ都可说明达到平衡状态,
故答案为:D;
(2)A.丙中浓度最大,甲中浓度最小,浓度越大,反应速率越大,则反应开始时,丙中的反应速率最快,甲中的反应最慢,故A正确;
B. 以甲计算:
H2O(g)+CO(g)?H2(g)+CO2(g)
起始:0 0 0.010 0.010
转化:x x x x
平衡:x x 0.01-x 0.01-x
则$\frac{(0.01-x)×(0.01-x)}{x{\;}^{2}}$=$\frac{4}{9}$,
x=0.006,则平衡时甲中的H2的转化率均是$\frac{0.006}{0.01}$=60%,由于甲和丙的气体的比值相同,为等效平衡状态,则丙中H2的转化率也为60%,故B正确;
C.由B计算可知,平衡时,丙中的c(CO2)是甲中的2倍,应为2×(0.01-0.006)mol/L=0.008mol/L,故C错误;
D.乙与甲相比较,相当于在甲的基础上通入H2,则平衡向逆反应方向移动,平衡时,乙中的CO2的转化率大于60%,故D正确.
故答案为:C.
点评 本题考查化学平衡以及反应热的计算,题目难度较大,本题注意利用三段式法计算,易错点为(2),注意对等效平衡的理解和运用.

①浓H2SO4的物质的量浓度;
②O2的溶解度;
③气体摩尔体积;
④阿伏加德罗常数;
⑤氧元素的相对原子质量;
⑥32gO2在标况下的体积.
其中变成原来2倍的是( )
| A. | ①②⑥ | B. | ②⑥ | C. | ③④⑤ | D. | ③④ |
| A. | NaOH | B. | H2SO4 | C. | 蔗糖 | D. | KCl |
| A. | 2.0 mol/L | B. | 1.5 mol/L | C. | 1.0 mol/L | D. | 0.5 mol/L |
| A. | CH2BrCH2Br 二溴乙烷 | B. | CH3CH(NH2)CH2COOH 3-氨基丁酸 | ||
| C. | 硬酯酸甘油脂 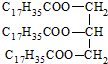 | D. | 2,2-二甲基-3-丁醇 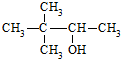 |
 .
.