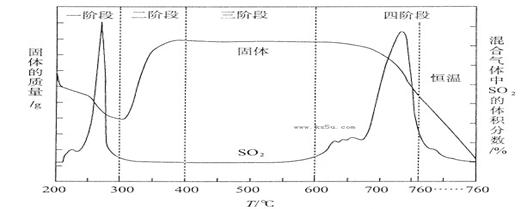
题目内容
使0.15molMnO2与过量的12mol?L-1的浓盐酸反应,使50mL12mol?L-1的浓盐酸与足量MnO2反应,两者产生的氯气相比(其他条件相同)( )
| A.一样多 | B.前者较后者多 |
| C.后者较前者多 | D.无法比较 |
0.15mol MnO2与过量的12mol?L-1的浓盐酸反应,浓盐酸过量,二氧化锰完全反应
MnO2 +4HCl(浓)
MnCl2+Cl2↑+2H2O
1 1
0.15mol 0.15mol
所以产生氯气的物质的量是0.15mol,
50mL 12mol?L-1的浓盐酸与足量MnO2反应,盐酸的物质的量为:12mol?L-1×0.05L=0.6mol,二氧化锰过量,若盐酸完全反应根据方程式计算
MnO2 +4HCl(浓)
MnCl2+Cl2↑+2H2O
4 1
0.6mol 0.15mol
所以理论上产生氯气的物质的量是0.15mol,
但是,50mL 12mol?L-1的浓盐酸与足量MnO2反应过程中盐酸的浓度不断减小,而稀盐酸与二氧化锰不发生反应,所以说最终产生的氯气小于0.15mol,
故A、C、D错误;
故选B.
MnO2 +4HCl(浓)
| ||
1 1
0.15mol 0.15mol
所以产生氯气的物质的量是0.15mol,
50mL 12mol?L-1的浓盐酸与足量MnO2反应,盐酸的物质的量为:12mol?L-1×0.05L=0.6mol,二氧化锰过量,若盐酸完全反应根据方程式计算
MnO2 +4HCl(浓)
| ||
4 1
0.6mol 0.15mol
所以理论上产生氯气的物质的量是0.15mol,
但是,50mL 12mol?L-1的浓盐酸与足量MnO2反应过程中盐酸的浓度不断减小,而稀盐酸与二氧化锰不发生反应,所以说最终产生的氯气小于0.15mol,
故A、C、D错误;
故选B.

练习册系列答案
相关题目
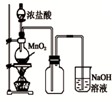

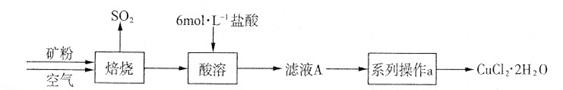

 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。