题目内容
2.将一定量的铜粉加入100mL浓硫酸中,加热发生反应:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,充分反应后放出13.44L(标准状况下)气体,固体有剩余,将反应后的溶液加水稀释至500mL.请按要求回答下列问题:(1)请用双线桥法分析该反应:
 .
.(2)浓硫酸在该反应中的作用是强氧化剂和酸.
(3)反应后Cu2+的物质的量浓度为多少?(简要写出计算过程)
分析 (1)该反应中Cu元素化合价由0价变为+2价、S元素化合价由+6价变为+4价,转移电子数为2;
(2)硫酸在反应中部分S元素化合价由+6价变为+4价,部分硫酸中各元素化合价不变;
(3)n(SO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,根据二氧化硫和铜离子之间的关系式计算铜离子物质的量,再根据c=$\frac{n}{V}$计算铜离子浓度.
解答 解:(1)该反应中Cu元素化合价由0价变为+2价、S元素化合价由+6价变为+4价,转移电子数为2,所以其电子转移方向和数目为 ,
,
故答案为: ;
;
(2)硫酸在反应中部分S元素化合价由+6价变为+4价,部分硫酸中各元素化合价不变,所以浓硫酸作酸和强氧化剂,故答案为:酸、氧化剂;
(3)n(SO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,根据二氧化硫和铜离子之间的关系式得n(SO2)=n(Cu 2+)=0.6mol,c(Cu 2+)=$\frac{n}{V}$=$\frac{0.6mol}{0.5L}$=1.2mol/L,
答:铜离子浓度为1.2mol/L.
点评 本题以Cu和浓硫酸的反应为载体考查氧化还原反应方程式的计算,明确各个物理量之间的关系即可解答,难点是标出电子转移方向和数目,题目难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 盐酸、氨气和碳酸钠都是电解质 | |
| B. | 常温常压下,22.4L CO2气体的物质的量大于1mol | |
| C. | 2.4克石墨和C60的混合物所含碳原子数约为0.2×6.02×1023 | |
| D. | 氢氧化铁胶体较稳定,是因为该胶体带有正电荷 |
13.关于右边一组图示的说法中错误的是( )
| A. |  用图实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  用图实验可用于比较铝、铁的金属性的强弱 | |
| C. |  图表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 | |
| D. | 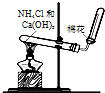 图装置可用于实验室制取氨气 |
14.某烷烃的相对分子质量是72,其同分异构体的数目是( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |



 .
.