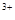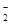题目内容
下列对明矾叙述错误的是
| A.明矾对酸性废水中的悬浮颗粒净化作用较弱 |
| B.用焰色反应检验明矾中的钾离子需用到蓝色钴玻璃 |
| C.向明矾的水溶液中滴加Ba(OH)2溶液,当硫酸根沉淀完全时,所得沉淀的质量最大 |
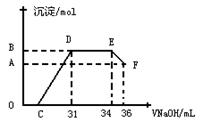
| D.向明矾的水溶液中滴加Ba(OH)2溶液,开始所得沉淀有两种且两种沉淀物质的量相同 |
D
试题分析:A、明矾为十二水硫酸铝钾,铝离子水解生成氢氧化铝沉淀具有吸附性,溶液呈酸性,在酸性废水中抑制了铝离子的水解,生成的沉淀量减小,使净化作用减弱、
B、因为钾离子的蓝色容易被其他离子的焰色覆盖,所以要透过蓝色钴玻璃才能看到钾离子的蓝紫色。
C、观察方程式可知,一摩尔的硫酸铝钾完全沉淀时需要2摩尔的钡离子,但只需要3摩尔的氢氧根离子,所以当硫酸根沉淀完全时,所得沉淀的质量最大。
D中开始有KAl(SO4)2+2Ba(OH)2="=2BaS" O4↓+Al(OH) 3↓+ KOH
刚开始产生沉淀的物质的量是不同的。
点评:明矾是需要学生重点掌握的化学物质,主要是针对它的净水的作用,其次是它的化学性质。

练习册系列答案
相关题目
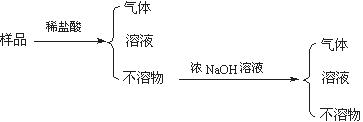
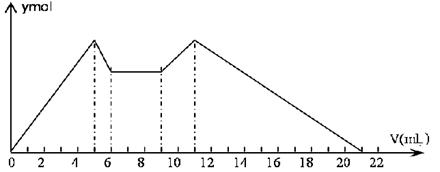
 全部转化成BaSO4沉淀,此时铝元素的存在形式是
全部转化成BaSO4沉淀,此时铝元素的存在形式是