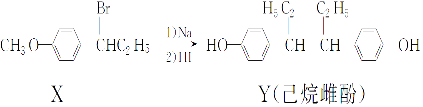��Ŀ����
����Ŀ��NiSO4xH2O��һ����ɫ������ˮ�ľ��壬�㷺���ڶ�������صȣ����ɵ�Ʒ����������⣬������ͭ��п������Ԫ�أ�Ϊԭ�ϻ�ã�����������ͼ�� 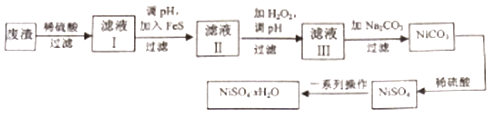
��1���ڴ��Ƽ��϶���ʱ�����Ƽ�Ӧ��������ƹ����е������ҺŨ�� �����������С���������䡱��
��2������Һ���м���FeS��Ϊ�˳�ȥCu2+��Zn2+�����ʣ����ȥCu2+�����ӷ���ʽΪ �� ��Zn2+ǡ�ó�����ȫʱ����CuS��ZnS����Ļ��Һ��c��Zn2+��=10��5mol/L����c��Cu2+��=mol/L ����֪Ksp��CuS��=1.3��10��36 �� Ksp��ZnS��=1.6��10��24����
��3������Һ�����ȼ�H2O2�ٵ�pH����pH��Ŀ���� ��
��4����Һ�����ʵ���Ҫ�ɷ���NiSO4 �� ����Na2CO3���˺��ټ�����ϡ�����ܽ�������NiSO4 �� ������������Ŀ���� ��
��5��Ϊ�ⶨNiSO4xH2O����x��ֵ����ȡ26.3g�����������ȫʧȥ�ᾧˮ��ʣ�����15.5g����x��ֵ���� ��
���𰸡�
��1����������
��2��FeS��aq��+Cu2+��aq��=Fe2+��aq��+CuS��aq����8.1��10��18
��3����ȥFe3+
��4������NiSO4��Ũ��,���������ᾧ����NiSO4��
��5��6
���������⣺��1���ڴ��Ƽ��϶��������Ƽ����������Ʋ���������������������Һ�������ӵ�����Һ���������������������ܽ�����������ʵ������Һ��Ũ�Ȳ��䣻
���Դ��ǣ��������䣻��2������Һ���м���FeS��ҪĿ���dz�ȥCu��Zn�����ʣ�˵��CuS���ܽ�ȸ�С����Ӧ�����ӷ���ʽΪFeS��aq��+Cu2+��aq��=Fe2+��aq��+CuS��aq����
��֪Ksp��CuS��=1.3��10��36��Ksp��ZnS��=1.6��10��24����Zn2+ǡ�ó�����ȫʱ����CuS��ZnS����Ļ��Һ��c��Zn2+��=10��5mol/L������Һ�е�c��S2����= ![]() =
= ![]() =1.6��10��19mol/L����c��Cu2+��=
=1.6��10��19mol/L����c��Cu2+��= ![]() =
= ![]() mol/L��8.1��10��18 mol/L��
mol/L��8.1��10��18 mol/L��
���Դ��ǣ�FeS��aq��+Cu2+��aq��=Fe2+��aq��+CuS��aq����8.1��10��18����3������Һ���ȼӹ������⣬������Fe2+����Fe3+������pH������ˮ����������������������ȥ��
���Դ��ǣ���ȥ Fe3+����4����Һ�����ʵ���Ҫ�ɷ���NiSO4���ټ���̼���ƹ��˺�ϡ�����ܽ�������NiSO4���������NiSO4Ũ�ȣ������������ᾧ��
���Դ��ǣ�����NiSO4��Ũ�ȣ����������ᾧ������NiSO4������5��26.3g�����������ȫʧȥ�ᾧˮ��ʣ�����15.5g��ʧȥˮ������=26.3g��15.5g=10.8g��NiSO4������Ϊ15.5g���������ʵ����õ�1��x= ![]() ��
�� ![]() �����x=6��
�����x=6��
���Դ��ǣ�6��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��A��B��C��D��EΪ������Ԫ�أ������ڱ���������λ������ͼ��ʾ��A��C����Ԫ�ص�ԭ�Ӻ��������֮�͵���Bԭ�ӵ���������Bԭ�Ӻ�������������������ȣ�
A | C | |
D | B | E |
��1��д������Ԫ������A________��B _______��C_______��
��2��BԪ��λ��Ԫ�����ڱ��е�______���ڣ�_______�塣
��3���Ƚ�B��D��E����Ԫ�ص�����������ˮ����������ǿ���ǣ��û�ѧʽ��ʾ��______��
��4��Cԭ�ӽṹʾ��ͼΪ________________��