题目内容
【题目】NA表示阿伏加德罗常数的数值,下列叙述不正确的是
A. 常温常压下,1.7 g氨气中含有的原子数目为0.4NA
B. 50 mL 1 mol·L1 K2SO4溶液中含有的K+数目为0.1NA
C. 5.6 g铁与足量稀硫酸反应转移的电子数为0.3NA
D. 标准状况下,4.48 L的氧气和氮气的混合物含有的分子数目为0.2NA
【答案】C
【解析】
A. 常温常压下,1.7 g氨气含有的原子数目为![]() =0.4NA,故不选A。
=0.4NA,故不选A。
B. 50 mL 1 mol·L1 K2SO4溶液中含有的K+数目为1 mol·L1×50×10-3L×2NA=0.1NA,故不选B。
C. Fe+H2SO4=FeSO4+ H2↑,5.6 g铁与足量稀硫酸反应转移的电子数应为![]() 0.2NA,故选C;
0.2NA,故选C;
D.标准状况下,4.48 L的氧气和氮气的混合物含有的分子数目为![]() 0.2NA,故不选D;
0.2NA,故不选D;
正确答案:C。

【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g 苯甲酸和20 mL 甲醇(密度约0.79g · mL-1) ,再小心加入3 mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是_________;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:__________________。
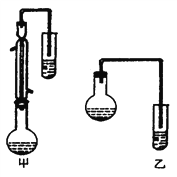
(2)甲和乙两位同学分别设计了如上图两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用_________装置(填“甲”或“乙”)。理由是___________________。
(3)反应物CH3 OH 应过量,理由是__________________________________。
II.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现按下列流程图进行精制,请在流程图中方括号内填入恰当操作方法的名称______________。
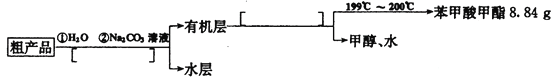
(5)通过计算,苯甲酸甲酯的产率为_________________________。