题目内容
几种短周期元素的原子半径及主要化合价见下表:
则下列叙述中不正确的是( )
| 元素符号 | A | B | C | D | E | F |
| 原子半径(nm) | 0.160 | 0.080 | 0.102 | 0.143 | 0.074 | 0.125 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 | +4 |
| A、B元素的金属性比A元素的强 |
| B、E与F形成的化合物是原子晶体 |
| C、C与E形成的化合物是分子晶体 |
| D、E的氢化物比C的氢化物沸点高 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:根据化合价可知,C、E为第ⅥA族元素,E是O,C为S,A和B的化合价都为+2价,应为ⅡA族元素,根据原子半径大小关系可知A为Mg、B为Be;D只有+3价,原子半径比Mg小,应为Al元素,F化合价只有+4价,应为ⅣA族元素,原子半径小于Al大于S,应为Si元素,然后结合元素化合物性质及反应原理来解答该题.
解答:
解:根据化合价可知,C、E为第ⅥA族元素,E是O,C为S,A和B的化合价都为+2价,应为ⅡA族元素,根据原子半径大小关系可知A为Mg、B为Be;D只有+3价,原子半径比Mg小,应为Al元素,F化合价只有+4价,应为ⅣA族元素,原子半径小于Al大于S,应为Si元素,
A.金属性Mg>Be,故A错误;
B.E与F形成的化合物是二氧化硅,是原子晶体,故B正确;
C.C与E形成的化合物是二氧化硫,是分子晶体,故C正确;
D.E的氢化物为水,含有氢键,沸点比C的氢化物高,故D正确.
故选A.
A.金属性Mg>Be,故A错误;
B.E与F形成的化合物是二氧化硅,是原子晶体,故B正确;
C.C与E形成的化合物是二氧化硫,是分子晶体,故C正确;
D.E的氢化物为水,含有氢键,沸点比C的氢化物高,故D正确.
故选A.
点评:本题考查原子结构与元素周期律的关系,为高频考点,元素的推断为解答本题的关键,注意利用化合价和原子半径来推断元素,注意O没有正价,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
在物质分类中常存在包含关系如图B包含A,下列关系中前者包含后者.其中错误的是( )
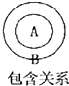

| A、有机物 烃 |
| B、烃 脂肪烃 |
| C、脂肪烃 烯烃 |
| D、烯烃 氯乙烯 |
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
| A、减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
原子序数在3~9之间的元素,随着核电荷数的递增而逐渐增大的是( )
| A、电子层数 | B、最外层电子数 |
| C、原子半径 | D、化合价 |
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A、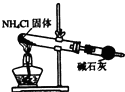 氨气发生装置 |
B、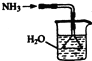 氨气吸收装置 |
C、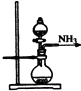 氨气发生装置 |
D、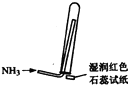 氨气收集、检验装置 |
用下列实验装置进行相应实验,能达到实验目的是( )
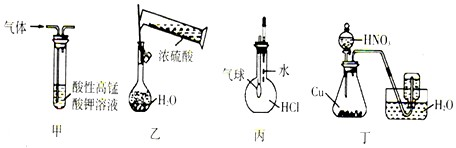

| A、装置甲:除去乙烯中混有的少量SO2 |
| B、装置乙:用浓硫酸配制1mol/L的硫酸 |
| C、装置丙:检验HCl气体在水中的溶解性 |
| D、装置丁:用铜和浓硝酸反应制取NO2 |
 A-I为原子序数递增的前四周期的元素,已知A原子的最外层电子数是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属.H为应用最广泛的金属;I处于周期表中的第IIB族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
A-I为原子序数递增的前四周期的元素,已知A原子的最外层电子数是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族.E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属.H为应用最广泛的金属;I处于周期表中的第IIB族.请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)