题目内容
20.某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝.查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾.用于有机合成和石油工业的催化剂,以及用于处理润滑油等.他们设计了以下装置,请结合题意回答问题: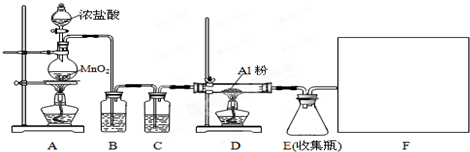
(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B的作用是除去Cl2中混有的HCl气体.
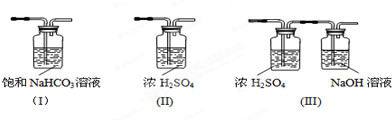
(3)请给标记为F的实线方框选择合适的装置III.
(4)AlCl3遇潮湿空气即产生大量白雾的原因是AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾(结合化学方程式说明).
(5)有同学认为装置E中有不足之处,存在安全隐患.若你同意他的观点,请指出其不足之处连接D、E间导管太细,生成的无水AlCl3易凝固导气管堵塞.
(6)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案.方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定.实验中所用NaOH溶液浓度为0.2000mol•L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应).
| 滴定次数 实验数据ml | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)终读数) | 22.60 | 22.55 | 22.65 | 23.00 |
②在本实验的滴定过程中,下列操作会使实验结果偏小的是df(填写序号).
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
海水粗盐试剂Ⅰ苦卤水(含K+、Mg2+、Br?等)MgMg(OH)2沉淀蒸发结晶┉┉
分析 浓盐酸和二氧化锰反应生成氯气,B中的饱和食盐水是为了除去混有的HCl气体,C中的浓硫酸是为了除去水,氯气与铝反应生成氯化铝,因为氯化铝易发生水解,故F应该防止空气中的水蒸气进入E装置和吸收尾气.
(1)根据浓盐酸和二氧化锰的性质判断生成物,从而确定方程式;
(2)B中的饱和食盐水是为了除去混有的HCl气体;
(3)F应该防止空气中的水蒸气进入E装置和吸收尾气;
(4)AlCl3遇水水解生成氢氧化铝和氯化氢;
(5)无水AlCl3在183℃时升华,遇潮湿空气即产生大量白雾,该装置存在安全隐患,在生成、收集氯化铝的位置发生导管堵塞;
(6)①先求出氢氧化钠的平均体积,由CHClVHCl=CNaOHVNaOH解题;
②根据c(待)=$\frac{c(标)×V(标)}{V(待)}$判断不当操作对相关物理量的影响.
解答 解:(1)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)B中的饱和食盐水是为了除去混有的HCl气体,
故答案为:除去Cl2中混有的HCl气体;
(3)F应该防止空气中的水蒸气进入E装置和吸收尾气,应选III,
故答案为:III;
(4)AlCl3遇水水解生成氢氧化铝和氯化氢,离子方程式:Al3++3H2O?Al(OH)3+3H+,
故答案为:AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾;
(5)无水AlCl3在183℃时升华,遇潮湿空气即产生大量白雾,该装置存在安全隐患,连接D、E间导管太细,在生成、收集氯化铝的位置D、E间导管易发生堵塞,
故答案为:连接D、E间导管太细,生成的无水AlCl3易凝固导气管堵塞;
(6)①反应消耗的V(NaOH)分别为22.60,22.55-0.5=22.05,22.65-0.7=21.95,23.00-1.00=22.00
平均为$\frac{22.60+22.05+21.95+22}{4}$=22.15mL
该次滴定测得试样中盐酸浓度为,由CHClVHCl=CNaOHVNaOH可得CHCl×20=0.2000×22.15 即盐酸的浓度为0.2215mol/L,
故答案为:0.2215;
②a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失,标准液题体积偏大,实验结果偏大;
b.未用标准NaOH溶液润洗滴定管,标准液的浓度偏小,体积偏大,实验结果偏大;
c.锥形瓶中加入待测盐酸后,再加少量水,实验结果无影响;
d.有少量液体溅出,溶质的物质的量减小,实验结果偏小;
e.滴定前锥形瓶用待测盐酸润洗,消耗标准液体积偏大,实验结果偏大;
f.观察读数时,滴定前仰视,滴定后俯视,读出体积偏小,实验结果偏小;
故答案为:df.
点评 本题考查了实验室制备氯气,中和滴定的实验操作,侧重实验基本操作和实验原理的考查,题目难度中等,注意把握实验设计的仪器连接顺序,清楚实验原理.


则下列结论正确的是( )
| A. | 该反应的化学方程式是A+3B═2C | |
| B. | 该反应的正反应为放热反应 | |
| C. | 定容条件下,混合气体的密度不再变化,则证明该反应达到平衡 | |
| D. | 压强增大,则该反应的正反应速率增大,逆反应速率减小 |
| A. | 溶液的质量分数为7.8% | B. | 溶液中溶质的质量大于7.8g | ||
| C. | 溶液中水的质量等于92.2g | D. | 溶液的质量等于100g |
| A. | 在FeSO4溶液中加入H2O2溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| B. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向FeBr2溶液中通入少量的氯气:2Br-+Cl2═2Cl-+Br2 | |
| D. | 向NaClO溶液中通入少量SO2:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
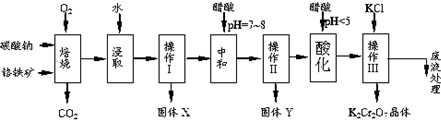
已知:①4FeO•Cr2O3+8Na2CO3+7O2$\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;②Na2CO3+Al2O3$\stackrel{750℃}{→}$2NaAlO2+CO2↑;③Cr2O72-+H2O═2CrO42-+2H+.根据题意回答下列问题:
(1)固体X中主要含有Fe2O3、MgO(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用pH计或精密pH试纸(填写仪器或试剂名称).
(2)酸化步骤用醋酸调节溶液pH<5,其目的是使CrO42-转化为Cr2O72-.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)如表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.该反应在溶液中能发生的理由是K2Cr2O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2O7的溶解度最小).
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
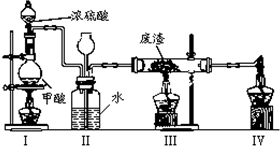
(6)六价铬有毒,而Cr3+相对安全.工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3.在实验室中模拟这一过程的装置如图:CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是III、I、IV.
 南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.