题目内容
11.将7.8gNa2O2溶于92.2g水中,下列说法正确的是( )| A. | 溶液的质量分数为7.8% | B. | 溶液中溶质的质量大于7.8g | ||
| C. | 溶液中水的质量等于92.2g | D. | 溶液的质量等于100g |
分析 n(Na2O2)=$\frac{7.8g}{78g/mol}$=0.1mol,与水发生反应:2Na2O2+2H2O=4NaOH+O2↑,根据方程式计算生成的NaOH和O2的质量,可得溶液的质量分数.
解答 解:解:n(Na2O2)=$\frac{7.8g}{78g/mol}$=0.1mol,与水发生反应:2Na2O2+2H2O=4NaOH+O2↑,
则n(NaOH)=2n(Na2O2)=0.2mol,n(O2)=$\frac{1}{2}$n(Na2O2)=005mol,
则m(NaOH)=0.2mol×40g/mol=8g,
m(O2)=0.05mol×32g/mol=1.6g,
所以溶液的质量为:7.8g+92.2g-1.6g=98.4g,
所以溶液质量分数为:$\frac{8g}{98.4g}$=8.13%.
只有B正确.
故选B.
点评 本题考查溶液质量分数的计算,侧重于学生的分析、计算能力的考查,题目难度不大,注意根据反应的方程式计算生成NaOH的质量和溶液的质量.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
2.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1.8 g重水(D2O)中含有的质子数和中子数均为NA | |
| B. | 将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA | |
| C. | 100 mL 12 mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6 NA | |
| D. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA |
6.下列溶液中各组离子因水解而不能够大量共存的是( )
| A. | AlO2-、Na+、HCO3-、K+ | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | K+、Al3+、Cl-、CO32- | D. | Cu2+、NH4+、I-、Cl- |
16.由空气中的自由电子附着在分子或原子上形成的空气负离子被称为“空气维生素”,O2-就是一种空气负离子,则O2-的摩尔质量为( )
| A. | 32 g | B. | 32 g/mol | C. | 34 g | D. | 34 g/mol |
20.某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝.查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾.用于有机合成和石油工业的催化剂,以及用于处理润滑油等.他们设计了以下装置,请结合题意回答问题:
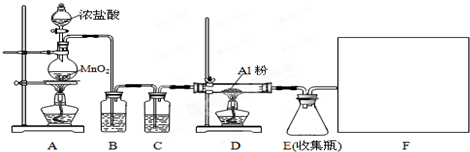
(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B的作用是除去Cl2中混有的HCl气体.
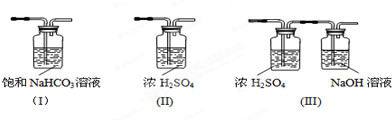
(3)请给标记为F的实线方框选择合适的装置III.
(4)AlCl3遇潮湿空气即产生大量白雾的原因是AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾(结合化学方程式说明).
(5)有同学认为装置E中有不足之处,存在安全隐患.若你同意他的观点,请指出其不足之处连接D、E间导管太细,生成的无水AlCl3易凝固导气管堵塞.
(6)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案.方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定.实验中所用NaOH溶液浓度为0.2000mol•L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应).
①经计算,该次滴定测的试样中盐酸浓度为0.2215mol•L-1.
②在本实验的滴定过程中,下列操作会使实验结果偏小的是df(填写序号).
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
海水粗盐试剂Ⅰ苦卤水(含K+、Mg2+、Br?等)MgMg(OH)2沉淀蒸发结晶┉┉

(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B的作用是除去Cl2中混有的HCl气体.
(3)请给标记为F的实线方框选择合适的装置III.

(4)AlCl3遇潮湿空气即产生大量白雾的原因是AlCl3遇水水解,Al3++3H2O?Al(OH)3+3H+,产生的氯化氢气体在空气中形成酸雾(结合化学方程式说明).
(5)有同学认为装置E中有不足之处,存在安全隐患.若你同意他的观点,请指出其不足之处连接D、E间导管太细,生成的无水AlCl3易凝固导气管堵塞.
(6)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案.方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定.实验中所用NaOH溶液浓度为0.2000mol•L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应).
| 滴定次数 实验数据ml | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)终读数) | 22.60 | 22.55 | 22.65 | 23.00 |
②在本实验的滴定过程中,下列操作会使实验结果偏小的是df(填写序号).
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
海水粗盐试剂Ⅰ苦卤水(含K+、Mg2+、Br?等)MgMg(OH)2沉淀蒸发结晶┉┉
1.下列过程中,化学键发生断裂的是( )
| A. | 挥发 | B. | 电解 | C. | 萃取 | D. | 蒸馏 |