题目内容
【题目】铁是生产生活中应用最广泛的一种金属。某化学学习小组在实验室中探究铁钉(主要成分为低碳钢)与热浓硫酸的反应。其探究流程如图所示:
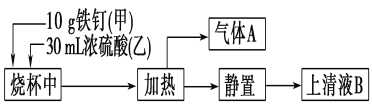
(1)从实验安全的角度考虑,应先向烧杯中加入______(填“甲”或“乙”);根据加入的反应物的量,实验需要选取的烧杯的规格为________(填字母序号)。
a.50 mL b.100 mL c.500 mL d.1 000 mL
(2)上清液B中可能既含Fe3+,又含Fe2+,要检验上清液B中有无Fe2+,应加入的试剂是________(填字母序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.NaOH溶液 d.酸性KMnO4溶液
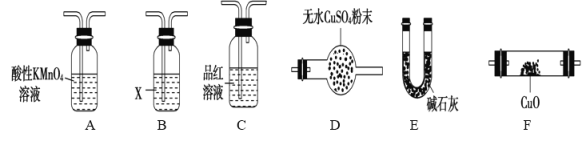
(3)气体A的主要成分是SO2,还可能含有H2和CO2。流程图中“加热”时可能生成CO2的原因是(用化学方程式表示)___________________。利用下列仪器可以同时检验气体A中是否含有H2和CO2(其中的夹持仪器、橡胶管和加热装置已经略去),则仪器的连接顺序是____________
(4)烧杯中的产物之一FeSO4有如下转化关系 (无关物质已略去)。
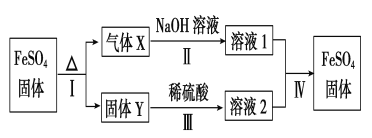
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。②Y是红棕色的化合物。反应Ⅰ的化学方程式为_________________X通入BaCl2溶液,产生白色沉淀的化学式为________
【答案】甲 b d C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O ACBEFDE 2FeSO4
2SO2↑+CO2↑+2H2O ACBEFDE 2FeSO4 ![]() Fe2O3+SO2↑+SO3↑ BaSO4
Fe2O3+SO2↑+SO3↑ BaSO4
【解析】
(1)先在烧杯中加铁钉,再加浓硫酸;烧杯中所盛反应的液体不能超过容积的一半;
(2)Fe2+具有还原性,能使酸性KMnO4溶液褪色;
(3)铁钉中含有少量的碳元素,C与浓硫酸反应生成二氧化碳、二氧化硫和水;
检验气体A中是否含有H2和CO2,应该先除去二氧化硫,然后用澄清石灰水检验二氧化碳,再干燥,然后通过CuO,与CuO反应生成水,用无水硫酸铜检验水的生成,即可证明有氢气.
(4)FeSO4分解得到气体X与红棕色固体Y,X由两种化合物组成,将X通入品红溶液,溶液褪色,而X通入BaCl2溶液,产生白色沉淀,则X为SO2、SO3混合物,结合转化关系可知Y为Fe2O3;
反应Ⅰ的反应方程式为:2FeSO4 ![]() Fe2O3+SO2↑+SO3↑;
Fe2O3+SO2↑+SO3↑;
X为SO2、SO3混合物,溶于水生成物中含有硫酸,与BaCl2溶液,产生白色沉淀为BaSO4。
(1)先在烧杯中加铁钉,再加浓硫酸,如果先加入浓硫酸,再加铁钉,则容易溅起浓硫酸伤人;根据加入的反应物的量,实验需要选取的烧杯的规格要大于30ml×2,故选100ml,即选b。
(2)由于铁钉生锈,上清液B中可能既含Fe3+,又含Fe2+,Fe2+具有还原性,能使酸性KMnO4溶液褪色,所以用酸性KMnO4溶液检验有无Fe2+;
故答案为:d;
铁钉中含有少量的碳元素,C与浓硫酸反应生成二氧化碳、二氧化硫和水,其反应的方程式为:C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
检验气体A中是否含有H2和CO2,应该先除去二氧化硫,所以把混合气体通过酸性KMnO4溶液,再通过酚酞试液检验二氧化硫是否吸收完全,然后把气体通过澄清石灰水,用澄清石灰水检验二氧化碳,再通过碱石灰干燥,然后通过灼热CuO,氢气与CuO反应生成水,用无水硫酸铜检验水的生成,即可证明有氢气,所以仪器的连接顺序是ACBEFDE;
(4)FeSO4分解得到气体X与红棕色固体Y,X由两种化合物组成,将X通入品红溶液,溶液褪色,而X通入BaCl2溶液,产生白色沉淀,则X为SO2、SO3混合物,结合转化关系可知Y为Fe2O3。
反应Ⅰ的反应方程式为:2FeSO4 ![]() Fe2O3+SO2↑+SO3↑;
Fe2O3+SO2↑+SO3↑;
X为SO2、SO3混合物,溶于水生成物中含有硫酸,与BaCl2溶液,产生白色沉淀为BaSO4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列关于物质分类的正确组合是( )
类别 组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | Na2CO3 | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | CuO | CH3COOH | KOH | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A.AB.BC.CD.D