题目内容
【题目】I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为________,Ba2+的物质的量为_______。
II.把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6 LH2(标准状况下)。
(1)合金中镁的物质的量_________。
(2)写出该合金溶于足量NaOH溶液的化学方程式_________。同时产生H2的体积(标准状况下)为____________ 。
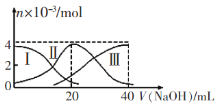
III.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示,则:

①生成Mg(OH)2的质量为__________;
②X=_______;Y=_________。
【答案】0.2 mol L-10.002 mol0.1 mol2Al+2NaOH+2H2O=2NaAlO2+3H2↑3.36 L5.8 g0.50.6
【解析】本题考查物质的量及物质的量浓度的有关计算,注意根据图像和化学方程式的比例关系计算。
I.根据电离方程式,BaCl2=Ba2++2Cl-,20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol·L-1,Ba2+的物质的量为0.02L×0.1mol/L=0.002mol。
II.(1)设合金中Mg的物质的量为xmol,铝的物质的量为ymol,根据得失电子守恒可列方程2x+3y=5.6L÷22.4L/mol×2,根据两者的质量和为5.1g可列方程24x+27y=5.1,解方程得:x=0.1mol,y=0.1mol。
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据化学方程式可知,0.1mol铝完全反应产生0.15mol氢气,0.15mol氢气在标准状况下的体积为0.15mol×22.4L/mol=3.36L。
III.①由图像可知,氢氧化镁和氢氧化铝沉淀的物质的量和为0.2mol,向沉淀中加入NaOH后,只有氢氧化铝和NaOH反应导致沉淀物质的量减少,不溶的0.1mol是氢氧化镁,所以生成氢氧化镁的质量为0.1mol×58g/mol=5.8g。
②根据离子反应:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,Al(OH)3 +OH- =AlO2- +2H2O,0.1mol镁离子消耗氢氧化钠0.2mol,0.1mol铝离子消耗氢氧化钠0.3mol,所以X=0.2+0.3=0.5mol,溶解氢氧化铝消耗氢氧化钠0.1mol,则Y=0.5+0.1=0.6mol。