题目内容
根据S2O82-+2e→2SO42-,Mn2++4H2O→MnO4-+8H++5e,推测氧化1.5molMn2+需要Na2A2O8的物质的量为
| A.1.5mol |
| B.3.75mol |
| C.3.25mol |
| D.3.125mol |
B
根据电子守恒,设需Na2S2O8xmol,锰元素由+2价升高到+7价,升了5价,硫由+7价降到+6价,两个硫降2价,则2x=1.5×5,x=3.75。选B。

练习册系列答案
相关题目
 K2MnO4+K3MnO4+MnO2+3O2↑
K2MnO4+K3MnO4+MnO2+3O2↑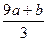 )mol
)mol
 ="===" 2KCl + 2CrCl3 + 3Cl2?+ 7H2O反应中。
="===" 2KCl + 2CrCl3 + 3Cl2?+ 7H2O反应中。