题目内容
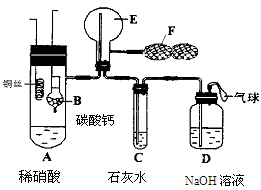
某化学小组用下列装置抽取收集纯净的氯气,并研究其性质。请回稳下列问题。
(1)装置A中发生反应的离子方程式为_______________________________。
(2)按照气流方向各仪器接口的连接顺序为a→___________________→g。
(3)装置B中浓硫酸的作用是__________________________,装置C的试剂最好是___________________________________。
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂。
| |
(5)装制取的氯气通入下图所示装置中,甲装置溶液中具有氧化性的含氯粒子是_______;如何证明乙装置中FeCl2溶液与Cl2发生了反应?(只回答需要的试剂和现象)_ 。

(1)MnO2+4H+ +2Cl- Mn2++Cl2 ↑+ 2H2O
Mn2++Cl2 ↑+ 2H2O
(2)bcedf
(3)吸收水蒸气,干燥氯气,饱和食盐水
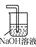
(4)
(5)Cl2 、HClO、ClO- ,KSCN溶液,溶液变成血红色
解析试题分析:(1)实验室制取氯气使用MnO2和浓盐酸。(2)先除去HCl杂质,再除去H2O杂质,最后收集。
(3)浓硫酸起到干燥的作用,除去HCl气体杂质使用饱和食盐水。(4)尾气吸收使用NaOH溶液。(5)Fe2+被氯气氧化为Fe3+ ,检验Fe3+使用KSCN溶液,溶液变成血红色。
考点:考察实验室制取氯气的原理和操作。能正确的处理除杂和尾气吸收。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。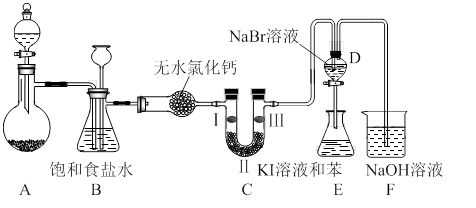
(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为: 。
(2)装置B的作用是 ,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 。(选a或b或c)
| | a | b | c |
| I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将D中的少量溶液加入E中,振荡E。观察到的现象是 。该现象 (填“能”或“不能”)说明溴的非金属性强于碘,原因是 。
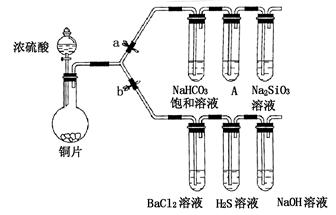

 Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O

 的物质的量浓度变化趋势为 ;
的物质的量浓度变化趋势为 ; 外,还存在另一种浓度较大的阴离子。为检验该阴离子,先取固体试样溶于水配成溶液。以下是检验该阴离子的两种实验方案你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。
外,还存在另一种浓度较大的阴离子。为检验该阴离子,先取固体试样溶于水配成溶液。以下是检验该阴离子的两种实验方案你认为合理的方案是 (填“甲”或“乙”),请说明另一方案不合理的原因 。 ,再加
,再加 溶液,有白色沉淀生成,证明该离子存在。
溶液,有白色沉淀生成,证明该离子存在。 固体加热到600℃以上分解的化学方程式 。
固体加热到600℃以上分解的化学方程式 。

 MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是
MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是