题目内容
【题目】热稳定系数和总氯量是漂白粉行业标准里的两个指标。
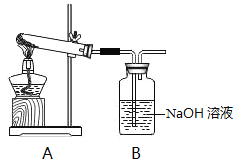
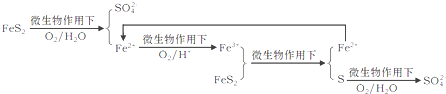
Ⅰ.利用如图装置,探究漂白粉的热分解产物。资料显示:久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2。
(1)加热干燥的漂白粉样品,观察到B中只有大量无色气泡产生,则次氯酸钙分解的固体产物中一定有_______________(填化学式)。
(2)加热久置于潮湿环境中的漂白粉样品,观察到B中也有气泡产生。B中发生反应的离子方程式为________________。
Ⅱ.测定漂白粉总氯的百分含量(即样品中氯元素总质量与样品总质量的比值),实验步骤如下:
①准确称取5.000 g漂白粉样品,研细,加蒸馏水溶解并冷却后,配制成500 mL溶液。
②移取25.00 mL该试样溶液至锥形瓶中,调节溶液pH,缓慢加入适量3% H2O2水溶液,搅拌至不再产生气泡。加入适量K2CrO4溶液作为指示剂,以0.1000 mol·L-1AgNO3标准溶液滴定至终点。多次实验,测得消耗AgNO3标准溶液的平均体积为25.00 mL。〔已知:Ksp (AgCl,白色)=1.56×10-10,Ksp (Ag2CrO4,砖红色)=9.0×10-12〕
(3)步骤①溶液配制中,所用的玻璃仪器有烧杯、玻璃棒、________、________。
(4)加入H2O2溶液,搅拌至不再产生气泡,目的是__________(用离子方程式表示)。
(5)滴定终点的现象是___________________________。
(6)该漂白粉总氯的百分含量为______________。
(7)下列操作会导致总氯百分含量测定结果偏高的是__________(填序号)。
A.指示剂K2CrO4的用量过多
B.在达到滴定终点读数时,俯视标准液液面
C.滴定前滴定管尖嘴部分有气泡,滴定后消失
【答案】CaCl2 2OH-+Cl2=Cl-+ ClO-+ H2O 500mL容量瓶 胶头滴管 ClO-+ H2O2=Cl-+O2↑+ H2O 当滴入最后一滴标准液,溶液中出现砖红色沉淀,且半分钟内不消失 35.5% C
【解析】
Ⅰ.(1)加热干燥的漂白粉样品,观察到B中有大量无色气泡,为产生的氧气,结合氧化还原反应中元素化合价的变化分析判断;
(2)久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
Ⅱ.(3)根据配制溶液的一般步骤分析判断需要的仪器;
(4)加入H2O2水溶液,搅拌至不再产生气泡,是利用过氧化氢的还原性还原次氯酸根离子生成氯离子,过氧化氢被氧化为氧气;
(5)加入适量K2CrO4溶液作为指示剂,以0.1000molL-1AgNO3标准溶液滴定至终点,溶液中出现砖红色沉淀Ag2CrO4;
(6)结合元素守恒,生成氯化银沉淀的氯离子来源于过氧化氢还原次氯酸根离子,Ag++Cl-=AgCl↓,据此计算漂白粉中总氯的百分含量;
(7)滴定过程中消耗标准溶液体积越多,测定结果越高,反之越低,据此分析判断。
Ⅰ.(1)久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2,加热干燥漂白粉样品,观察到B中有大量无色气泡,为产生的氧气,氧化还原反应中存在元素化合价的升高和降低,氧元素化合价升高,氯元素化合价降低,则氯元素化合价变化为-1价,生成固体产物为氯化钙,化学式为CaCl2,故答案为CaCl2;
(2)①久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,B中发生反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,故答案为2OH-+Cl2=Cl-+ClO-+H2O;
Ⅱ.(3)准确称取5.000g漂白粉样品,研细,加蒸馏水溶解并冷却后,稀释至500mL需要在容量瓶中进行,配制过程需要经过溶解、转移、洗涤、定容摇匀等步骤,所用的玻璃仪器有烧杯、玻璃棒、500mL容量瓶、胶头滴管,故答案为500mL容量瓶;胶头滴管;
(4)加入H2O2水溶液,搅拌至不再产生气泡,是利用过氧化氢的还原性还原次氯酸根离子生成氯离子,过氧化氢被氧化为氧气,反应的离子方程式为:ClO-+H2O2=Cl-+O2↑+H2O,故答案为ClO-+H2O2=Cl-+O2↑+H2O;
(5)加入适量K2CrO4溶液作为指示剂,以0.1000molL-1AgNO3标准溶液滴定至终点,滴定终点的现象是:当滴入最后一滴标准液,溶液中出现砖红色Ag2CrO4沉淀,且半分钟内不消失,故答案为当滴入最后一滴标准液,溶液中出现砖红色沉淀,且半分钟内不消失;
(6)准确称取5.000g漂白粉样品,研细,加蒸馏水溶解并冷却后,稀释至500mL,移取25.00mL该试样溶液至锥形瓶中,调节pH,缓慢加入适量3% H2O2水溶液,搅拌至不再产生气泡。加入适量K2CrO4溶液作为指示剂,以0.1000molL-1AgNO3标准溶液滴定至终点,多次实验,测得消耗AgNO3标准溶液平均体积为25.00mL,氯元素守恒,得到该漂白粉总氯的百分含量=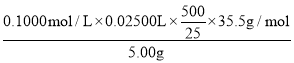 ×100%=35.5%,故答案为35.5%;
×100%=35.5%,故答案为35.5%;
(7)A.指示剂K2CrO4的用量过多,根据Ksp 可知,可能会导致消耗标准溶液的体积偏小,滴定结果可能偏低,故A错误;B.在滴定终点读取滴定管刻度时,俯视标准液液面,导致消耗标准溶液的体积偏小,测定结果偏低,故B错误;C.滴定前滴定管尖嘴部分有气泡,滴定后消失,导致消耗标准溶液的体积偏大,测定结果偏高,故C正确;故答案为C。

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】苯甲酸钠是一种常见食品防腐剂。实验室制备苯甲酸的装置图和有关数据如下:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
苯甲酸钠 | 144 | ---- | 249.3 | 易溶于水 |
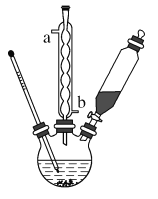
(1)制备苯甲酸:在三颈烧瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失。将三颈烧瓶在冰水浴中冷却,分离出苯甲酸。
①球形冷凝管的作用是_________,其进水口是________(填“a”或“b”)。
②已知三颈烧瓶中反应的离子方程式为![]() +6MnO4-+18H+→
+6MnO4-+18H+→![]() +6Mn2++14H2O,在该反应中体现了甲苯____性。
+6Mn2++14H2O,在该反应中体现了甲苯____性。
③分离苯甲酸选用的玻璃仪器除玻璃棒、烧杯外还有________(填字母)。
A.分液漏斗 B.漏斗 C.蒸馏烧瓶 D.直形冷凝管
④分离出粗品苯甲酸晶体中可能含有的杂质是MnSO4和___,为进一步提纯,应采用的操作方法是______。
(2)制备苯甲酸钠:控制温度为70℃,向三颈烧瓶中加入61.0g苯甲酸和适量的32%碳酸钠溶液,充分反应后停止加热。在深色的溶液中加入活性炭,并将混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体。
⑤控制温度为70℃的方法是_______。
⑥加入活性炭的作用是___________。
⑦若提纯得到46.8g苯甲酸钠,则苯甲酸钠的产率________。(保留三位有效数字)
【题目】实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度g/l00g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
操作如下:
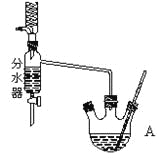
①在50mL三颈烧瓶中投入几粒沸石,将18.5 mL正丁醇和13.4 mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥。
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1 g乙酸正丁酯。
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式___________。
(2)仪器A中发生反应的化学方程式为___________________。
(3)步骤①向三颈烧瓶中依次加入的药品是:__________________。
(4)步骤②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是____________。
(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏___,(填“高”或“低”)原因是__。
(6)该实验生成的乙酸正丁酯的产率是_________。
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25