题目内容
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
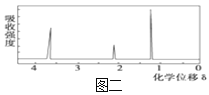
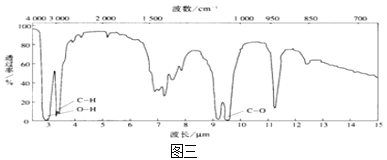
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3;
④用红外光谱仪处理该化合物,得到如图三所示图谱。
试回答下列问题:

(1)有机物A的相对分子质量是___________;
(2)有机物A的实验式是___________;
(3)推测有机物A的结构简式为___________,A中含官能团的名称是_________;
(4)质量分数为11.6%的某饱和一元醛水溶液5 g,跟足量新制的Cu(OH)2悬浊液反应,生成Cu2O1.44 g。通过计算推导出该有机物的分子式并写出其结构简式_______、________。
【答案】46 C2H6O CH3CH2OH 羟基 C3H6O CH3CH2CHO
【解析】
(1)根据质谱图(图一)分析判断;
(2)根据n=![]() 计算生成的水的物质的量,再计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素,若含有氧元素,计算氧元素质量、氧原子物质的量,根据原子守恒确定有机物A中C、H、O原子个数比值确定最简式;
计算生成的水的物质的量,再计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素,若含有氧元素,计算氧元素质量、氧原子物质的量,根据原子守恒确定有机物A中C、H、O原子个数比值确定最简式;
(3)根据图二、三可知,结合化学式分析写出结构简式;
(4)饱和一元醛与新制的Cu(OH)2悬浊液反应关系为R-CHO~Cu2O,根据Cu2O的质量结合反应关系分析计算。
(1)根据质谱图(图一)的质荷比可知,有机物A的相对分子质量为46,故答案为:46;
(2)2.3g有机物燃烧生成0.1molCO2,2.7g水,则n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,n(H2O)=![]() =0.15mol,n(H)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,则m(C)+m(H)=1.2g+0.3g=1.5g<2.3g,故有机物含有O元素,且m(O)=2.3g-1.5g=0.8g,故n(O)=
=0.15mol,n(H)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,则m(C)+m(H)=1.2g+0.3g=1.5g<2.3g,故有机物含有O元素,且m(O)=2.3g-1.5g=0.8g,故n(O)=![]() =0.05mol,n(C)∶n(H)∶n(O)=0.1mol∶0.3mol∶0.05mol=2∶6∶1,即该有机物最简式为:C2H6O,故答案为:C2H6O;
=0.05mol,n(C)∶n(H)∶n(O)=0.1mol∶0.3mol∶0.05mol=2∶6∶1,即该有机物最简式为:C2H6O,故答案为:C2H6O;
(3)由图三可知,该有机物分子中含有O-H键、C-O键和C-H键,其分子式为C2H6O,故该有机物结构式为:CH3CH2OH,满足核磁共振氢谱三个峰的面积之比是1∶2∶3,含有的官能团为羟基,故答案为:CH3CH2OH;羟基;
(4)设该饱和一元醛的结构简式为R-CHO,质量分数为11.6%的某饱和一元醛水溶液5g,醛的质量为11.6%×5g=0.58g,n(Cu2O)=![]() =0.01mol,根据R-CHO~Cu2O可知n(R-CHO)=0.01mol,所以醛的相对分子质量为
=0.01mol,根据R-CHO~Cu2O可知n(R-CHO)=0.01mol,所以醛的相对分子质量为![]() =58,则R的式量为58-29=29,R为-CH2CH3,则该有机物的分子式为C3H6O,结构简式为CH3CH2CHO,故答案为:C3H6O;CH3CH2CHO。
=58,则R的式量为58-29=29,R为-CH2CH3,则该有机物的分子式为C3H6O,结构简式为CH3CH2CHO,故答案为:C3H6O;CH3CH2CHO。

 名校课堂系列答案
名校课堂系列答案