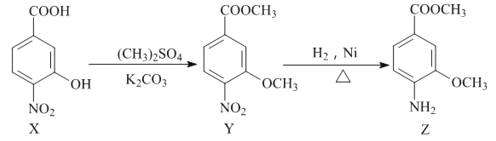
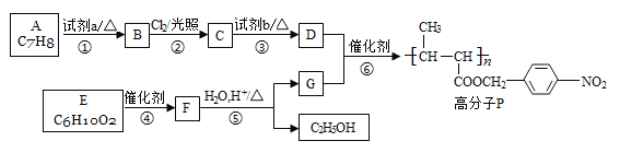
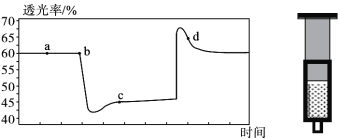
题目内容
【题目】将NO2装入带活塞的密闭容器中,当反应2NO2(g) ![]() N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是( )
N2O4(g)达到平衡后,改变下列一个条件,其中叙述错误的是( )
A. 升高温度,气体颜色加深,则此正反应为吸热反应
B. 慢慢压缩气体体积,平衡向右移动,混合气体颜色较原来深
C. 慢慢压缩气体使体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入惰性气体,压强增大,平衡不会移动
【答案】A
【解析】
根据平衡移动原理、平衡常数表达式分析回答。
A项:NO2(g)红棕色、N2O4(g)无色。升高温度使气体颜色加深,则平衡左移。据平衡移动原理,逆反应吸热,正反应放热,A项错误;
B项:压缩气体体积即加压,平衡向右移动,使体积减小、n(N2O4)增大,故c(N2O4)增大。又据K=![]() ,c(NO2)增大,混合气体颜色较原来深,B项正确;
,c(NO2)增大,混合气体颜色较原来深,B项正确;
C项:压缩气体使体积减小,则压强增大。若体积减半时平衡没有移动,则压强加倍。实际平衡右移,使压强小于原来的两倍,C项正确;
D项:恒温恒容时,充入惰性气体,虽然容器内总压强变大,但没有改变c(NO2)、c(N2O4),正、逆反应速率均不变,化学平衡不会移动,D项正确。
本题选A。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】探究铝片与Na2CO3溶液的反应。
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
下列说法不正确的是
A. Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH-
B. 对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C. 推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D. 加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
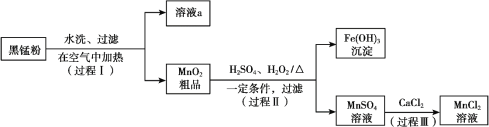
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。
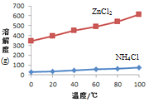
① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。