题目内容
某课外活动小组,称取了10.8 g青铜进行研究,他们将青铜放入过量稀盐酸中,得到SnCl2和PbCl2的混合溶液,收集到的气体在101 kPa下,冷却到25 ℃是272 mL,冷却到10 ℃是267 mL。已知该青铜合金中铜的质量分数是84.8%,试求该青铜合金中锡、铅的质量分数。
Sn:11.6% Pb:2.8%
解析:
青铜是Cu、Sn、Pb合金。Cu与HCl不反应,Sn、Pb与HCl发生置换反应,则:
Sn+2HCl══SnCl2+H2↑
119 g 22.4 L
m(Sn) ![]()
Pb+2HCl══PbCl2+H2↑
207 g 22.4 L
m(Pb) ![]()
由题意得:

解得![]()
则w(Sn)=![]() ×100%=11.6%
×100%=11.6%
w(Pb)=![]() ×100%=2.8%
×100%=2.8%

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
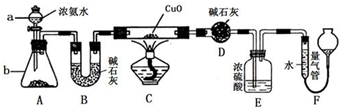 某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如图实验(夹持装置未画出)进行实验.请回答下列问题:
某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如图实验(夹持装置未画出)进行实验.请回答下列问题: