题目内容
某课外活动小组,称取了
解析:青铜是Cu、Sn、Pb合金。Cu与HCl不反应,Sn、Pb与HCl发生置换反应,则:
Sn+2HCl══SnCl2+H2↑
m(Sn) ![]()
Pb+2HCl══PbCl2+H2↑
m(Pb) ![]()
由题意得:
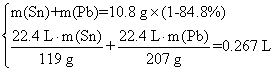
解得![]()
则w(Sn)=![]() ×100%=11.6%
×100%=11.6%
w(Pb)=![]() ×100%=2.8%
×100%=2.8%
答案:Sn:11.6% Pb:2.8%

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
题目内容
某课外活动小组,称取了
解析:青铜是Cu、Sn、Pb合金。Cu与HCl不反应,Sn、Pb与HCl发生置换反应,则:
Sn+2HCl══SnCl2+H2↑
m(Sn) ![]()
Pb+2HCl══PbCl2+H2↑
m(Pb) ![]()
由题意得:
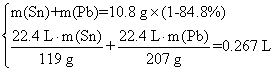
解得![]()
则w(Sn)=![]() ×100%=11.6%
×100%=11.6%
w(Pb)=![]() ×100%=2.8%
×100%=2.8%
答案:Sn:11.6% Pb:2.8%

 考前必练系列答案
考前必练系列答案