题目内容
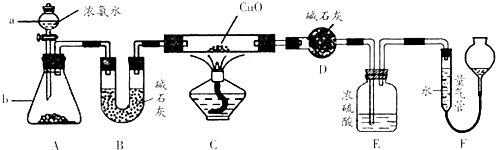
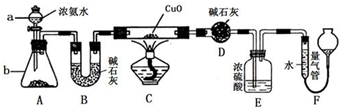 某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如图实验(夹持装置未画出)进行实验.请回答下列问题:
某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如图实验(夹持装置未画出)进行实验.请回答下列问题:(1)仪器a的名称为
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体.实验前称取黑色CuO 80g,实验后得到红色固体质量为68g.则红色固体成分的化学式为
(3)E装置中浓硫酸的作用是
(4)F中读取气体体积前,应对装置F进行的操作是:
(5)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据
A.B装置实验前后质量差m g; B.F装置实验前后液面差V L;
C.D装置实验前后质量差m g; D.E装置实验前后质量差m g.
分析:(1)依据装置仪器分析回答,浓氨水滴入锥形瓶中利用固体溶解放热使一水合氨分解生成氨气,需要选择氢氧化钠固体,氧化钙固体或碱石灰;
(2)C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,依据机制分析计算判断;
(3)E装置中浓硫酸的作用依据装置图分析判断是利用浓硫酸吸收过量氨气,同时避免F装置中的水蒸气进入D;
(4)依据量气管的使用方法回答;
(2)C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,依据机制分析计算判断;
(3)E装置中浓硫酸的作用依据装置图分析判断是利用浓硫酸吸收过量氨气,同时避免F装置中的水蒸气进入D;
(4)依据量气管的使用方法回答;
解答:解:(1)装置中仪器a为分液漏斗;仪器b是利用分液漏斗中滴入的氨水使锥形瓶中的固体溶解放热促进一水合氨分解生成氨气,氢氧化钠固体、氧化钙固体、碱石灰固体,
故答案为:分液漏斗;固体氢氧化钠或氧化钙或碱石灰;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,实验前称取黑色CuO 80g,物质的量为1mol,依据铜元素守恒,结合红色物质可能为铜或氧化亚铜,若为铜质量为64g,若为氧化亚铜质量=0.5mol×144g/mol=72g,实验后得到红色固体质量为68g.则红色固体成分的化学式为Cu和Cu2O;
故答案为:Cu和Cu2O;
(3)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果;
故答案为:吸收未反应的氨气,阻止F中水蒸气进入D;
(4)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数;若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积偏小,气体溶于水是碱性溶液,需要选择碱式滴定管,选择B;
故答案为:慢慢上下移动右边漏斗,使左右两管液面相平;偏小,B;
(5)若测得干燥管D增重为水物质的量,装置F测得气体的体积为为N2,计算得到气体物质的量,依据元素守恒得到氮原子和氢原子物质的量之比,所以选择BC;
故答案为:B、C;
故答案为:分液漏斗;固体氢氧化钠或氧化钙或碱石灰;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,实验前称取黑色CuO 80g,物质的量为1mol,依据铜元素守恒,结合红色物质可能为铜或氧化亚铜,若为铜质量为64g,若为氧化亚铜质量=0.5mol×144g/mol=72g,实验后得到红色固体质量为68g.则红色固体成分的化学式为Cu和Cu2O;
故答案为:Cu和Cu2O;
(3)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果;
故答案为:吸收未反应的氨气,阻止F中水蒸气进入D;
(4)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数;若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积偏小,气体溶于水是碱性溶液,需要选择碱式滴定管,选择B;
故答案为:慢慢上下移动右边漏斗,使左右两管液面相平;偏小,B;
(5)若测得干燥管D增重为水物质的量,装置F测得气体的体积为为N2,计算得到气体物质的量,依据元素守恒得到氮原子和氢原子物质的量之比,所以选择BC;
故答案为:B、C;
点评:本题考查了氨气的实验室制备,性质验证和反应现象分析判断判断,装置流程分析,量气装置的使用方法,测定元素物质的量之比的计算,题目难度中等.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
 某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;
某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;