ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ“―÷Σ98%ΒΡ≈®ΝρΥαΟήΕ»ΈΣ1.84g/cm3ΓΘ
Θ®1Θ©ΗΟΝρΥαΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣmolΓΛLΘ≠1ΓΘ
Θ®2Θ©ΔΌ”ΟΗΟ≈®Ε»ΒΡΝρΥα≈δ÷Τ500 mL 0.1 molΓΛLΘ≠1ΝρΥα ±Θ§–ηΗΟ≈®Ε»ΒΡΝρΥαΒΡΧεΜΐΈΣmLΘ§”ΟΒΫΒΡ≤ΘΝß“«Τς”–ΝΩΆ≤ΓΔ…’±≠ΓΔ≤ΘΝßΑτΓΔΓΘ
ΔΎœ¬Ν–≤ΌΉςΜα ΙΥυ≈δΝρΥα≈®Ε»ΤΪΗΏΒΡ «ΓΘ
AΘ°Έ¥œ¥Β”…’±≠ΚΆ≤ΘΝßΑτ BΘ°Ε®»ί ±Θ§Φ”Υ°≥§ΙΐΩΧΕ»œΏΚσΘ§Έϋ≥ωΕύ”ύ≤ΩΖ÷
CΘ°Ε®»ί ±Θ§Η© ”ΩΧΕ»œΏ DΘ°»ίΝΩΤΩœ¥ΨΜΚσΈ¥Η…‘ο
Θ®3Θ©»ΓœΓ ΆΚσΒΡ ΝΩΝρΥα”κΉψΝΩΒΡ–ΩΝΘΖ¥”ΠΘ§…ζ≥…±ξΉΦΉ¥Ωωœ¬11.2 L H2 Θ§ ‘ρΖ¥”Π÷–ΉΣ“ΤΒΡΒγΉ” ΐΈΣΗωΓΘ
ΓΨ¥πΑΗΓΩ
Θ®1Θ©18.4
Θ®2Θ©2.7,500 mL»ίΝΩΤΩ,ΫΚΆΖΒΈΙή,C
Θ®3Θ©NA Θ®6.02ΓΝ1023Θ©
ΓΨΫβΈωΓΩΘ®1Θ©c =(1000Π―ΠΊ)/M= ![]() molL-1=18.4 molL-1ΓΘ
molL-1=18.4 molL-1ΓΘ
Θ®2Θ©ΔΌΗυΨίœΓ ΆΕ®¬…ΘΚc1V1=c2V2ΒΟΘ§18.4 molL-1ΓΝV mLΓΝ10-3LmL-1=0.1molL-1ΓΝ500 mLΓΝ10-3LmL-1Θ§ΫβΒΟVΓ÷2.7ΘΜ”Ο≈®ΝρΥα≈δ÷Τ500 mL 0.1 molL-1ΝρΥα”ΟΒΫΒΡ≤ΘΝß“«Τς≥ΐΝΥΝΩΆ≤ΓΔ…’±≠ΓΔ≤ΘΝßΑτΆβΘ§ΜΙ”–500 mL»ίΝΩΤΩΚΆΕ®»ί”ΟΒΡΫΚΆΖΒΈΙήΓΘΔΎΗυΨίc=n/VΘ§Έσ≤νΖ÷Έω ±÷ς“ΣΩ¥≤ΌΉς‘λ≥…nΚΆVΒΡ±δΜ·ΘΜAœνΘ§Έ¥œ¥Β”…’±≠ΚΆ≤ΘΝßΑτΜα ΙnΤΪ–ΓΘ§‘ρcΤΪΒΆΘΜBœνΘ§Ε®»ί ±Θ§Φ”Υ°≥§ΙΐΩΧΕ»œΏΘ§Μα ΙVΤΪ¥σΘ§‘ρcΤΪΒΆΘ§Φ¥ ΙΈϋ≥ωΕύ”ύ≤ΩΖ÷Θ§“≤≤ΜΜαΗΡ±δ≈®Ε»ΤΪΒΆΒΡ ¬ Β(“ρΈΣΈϋ≥ωΒΡ «»ή“Κ)ΘΜCœνΘ§Ε®»ί ±Η© ”ΩΧΕ»œΏΘ§Μα ΙVΤΪ–ΓΘ§‘ρcΤΪΗΏΘΜDœνΘ§»ίΝΩΤΩœ¥ΨΜΚσΈ¥Η…‘ο≤Μ”Αœλ Β―ιΫαΙϊΓΘΉέ…œΘ§―ΓCΓΘ
Θ®3Θ©±ξΉΦΉ¥Ωωœ¬11.2LH2ΒΡΈο÷ ΒΡΝΩ «ΘΚ11.2LΓ¬22.4Lmol-1=0.5molΘ§ΗυΨίΖ¥”ΠΜ·―ßΖΫ≥Χ ΫΘΚZn+H2SO4=ZnSO4+H2ΓϋΘ§H‘ΣΥΊΜ·ΚœΦέ”…0…ΐΈΣ+1Θ§»τ…ζ≥…1molH2‘ρΉΣ“Τ2molΒγΉ”Θ§Υυ“‘…ζ≥…0.5molH2‘ρΉΣ“Τ1molΒγΉ”Θ§Φ¥…ζ≥…±ξΉΦΉ¥Ωωœ¬11.2LH2ΉΣ“ΤΒγΉ” ΐΈΣNAΘ®6.02ΓΝ1023Θ©ΓΘ
ΓΨΩΦΒψΨΪΈωΓΩΫβ¥π¥ΥΧβΒΡΙΊΦϋ‘Ύ”ΎάμΫβΈο÷ ΒΡΝΩ≈®Ε»ΒΡΗ≈ΡνΒΡœύΙΊ÷Σ ΕΘ§’ΤΈ’“‘ΒΞΈΜΧεΜΐάοΥυΚ§»ή÷ BΒΡΈο÷ ΒΡΝΩά¥±μ Ψ»ή“ΚΉι≥…ΒΡΈοάμΝΩΘ§Ϋ–Ήω»ή÷ BΒΡΈο÷ ΒΡΝΩ≈®Ε»ΘΜΖϊΚ≈CB=nB(mol)Θ·V(L) Θ®nB «»ή÷ BΒΡΈο÷ ΒΡΝΩΘ§V «»ή“ΚΧεΜΐΘ©Θ§ΒΞΈΜ «molΓΛLΓΞ1Θ§“‘ΦΑΕ‘≈δ÷Τ“ΜΕ®Έο÷ ΒΡΝΩ≈®Ε»ΒΡ»ή“ΚΒΡάμΫβΘ§ΝΥΫβ≈δ÷ΤΈο÷ ΒΡΝΩ≈®Ε»»ή“Κ ±Θ§œ»”Ο…’±≠Φ”’τΝσΥ°÷Ν»ίΝΩΤΩΩΧΕ»œΏ1cmΓΪ2cmΚσΘ§‘ΌΗΡ”ΟΫΜΆΕΒΈΙήΦ”Υ°÷ΝΩΧΕ»œΏΘ°

 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗΓΨΧβΡΩΓΩΈόΜζΜ·ΚœΈοΩ…ΗυΨίΤδΉι≥…ΚΆ–‘÷ Ϋχ––Ζ÷άύ
Θ®1Θ©œ¬ΆΦΥυ ΨΒΡΈο÷ Ζ÷άύΖΫΖ®Οϊ≥Τ «ΓΘ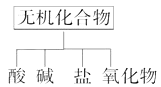
Θ®2Θ©“‘NaΓΔKΓΔHΓΔOΓΔCΓΔSΓΔN÷–»ΈΝΫ÷÷Μρ»ΐ÷÷‘ΣΥΊΉι≥…Κœ ΒΡΈο÷ Θ§Ζ÷±πΧν‘Ύœ¬±μΔΎΔέΔόΒΡΚσΟφΓΘ
Έο÷ άύ±π | Υα | Φν | ―Έ | ―θΜ·Έο |
Μ·―ß | ΔΌHCl | Δέ | ΔίNa2CO3 | ΔΏCO2 |
Θ®3Θ©–¥≥ωΔΏΉΣΜ·ΈΣΔίΒΡΜ·―ßΖΫ≥Χ ΫΓΘ
Θ®4Θ© Β―ι “÷Τ±ΗΔΏ≥Θ”ΟΚΆΖ¥”ΠΘ§Φλ―ιΗΟΤχΧεΒΡΖΫΖ® «ΓΘ

