��Ŀ����
����Ŀ��X��Y��Z��Q��W��R���ֶ�����Ԫ��ԭ���������������������X��Z��Q����Ԫ����ɣ�������0.1mol/L����Һ��pH=13����ҵ�ϳ��õ�ⱥ��QR��Һ���ɼף�����������X��R����Ԫ����ɣ���ش��������⣺
��1��Q��ԭ�ӽṹʾ��ͼΪ ��
��2��YԪ�صĵ����ܷ�����ͼ��ʾ��ת������YԪ��Ϊ����Ԫ�ط��ű�ʾ�����ڼ���Һ��ͨ������YZ2���壬������Һ�ʼ��ԣ�ԭ�����������ӷ���ʽ�ͱ�Ҫ������˵������
��3��W�ĵ��ʼ��������Һ��Ӧ������������Һ��Ӧ�� �ٳ����£���W�ĵ��ʺͼ���Һ��ϣ�������Ӧ�����ӷ���ʽΪ�� ��
��Q��W����Ԫ�ؽ����Ե�ǿ��ΪQW�������������������
���б�����֤����һ��ʵ���� ��
a��Q�ĵ��ʵ��۵��W���ʵ�
b��Q������������ˮ����ļ��Ա�W������������ˮ����ļ���ǿ
c��W��ԭ��������
���𰸡�
��1��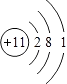
��2��C��HCO3��+H2O?H2CO3+OH�� �� ̼���������ˮ��̶ȴ��������̶�
��3��2Al+2OH��+2H2O�T2AlO2��+3H2��������b
���������⣺X��Y��Z��Q��W��R���ֶ�����Ԫ��ԭ���������������������X��Z��Q����Ԫ����ɣ�������0.1mol/L����Һ��pH=13�����Ϊǿ���Ϊ������Ԫ�أ��������������ƣ� X��Z��Qԭ������������������X��HԪ�أ�Z��OԪ�أ�Q��NaԪ�أ�
��ҵ�ϳ��õ�ⱥ���Ȼ�����Һ�����������ƣ�����R��ClԪ�أ�
����������H��Cl����Ԫ����ɣ���������HCl��
W�ĵ��ʼ���������������Һ��Ӧ��������������Һ��Ӧ����W��AlԪ�أ�
Y��ԭ������С��OԪ�أ�Y��������������������������仯�ϼ�֪��YΪCԪ�أ���1��Q��NaԪ�أ���ԭ�Ӻ�����11�����ӡ�3�����Ӳ㣬�Ƶ�ԭ�ӽṹʾ��ͼΪ 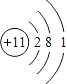 ��
��
���Դ��ǣ� 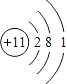 ����2��ͨ�����Ϸ���֪��YΪCԪ�أ�������������Һ��ͨ������CO2���壬���߷�Ӧ����̼�����ƣ�̼��������Ӽ���ˮ��Ҳ�ܵ��룬������̶�С��ˮ��̶ȣ�������Һ�ʼ��ԣ�
����2��ͨ�����Ϸ���֪��YΪCԪ�أ�������������Һ��ͨ������CO2���壬���߷�Ӧ����̼�����ƣ�̼��������Ӽ���ˮ��Ҳ�ܵ��룬������̶�С��ˮ��̶ȣ�������Һ�ʼ��ԣ�
���Դ��ǣ�C��HCO3��+H2OH2CO3+OH�� �� ̼���������ˮ��̶ȴ��������̶ȣ���3���ٳ����£���������������Һ��Ӧ����ƫ�����ƺ�������������Ӧ�����ӷ���ʽΪ��2Al+2OH��+2H2O�T2AlO2��+3H2����
���Դ��ǣ�2Al+2OH��+2H2O�T2AlO2��+3H2������Na��Al����Ԫ�ؽ����Ե�ǿ��ΪQ��W�������Ľ�����Խǿ�����Ӧ����������ˮ�������Խǿ�����ᷴӦԽ����ʧȥ���ӣ���ѡb��
���Դ��ǣ�����b��

 ��У����ϵ�д�
��У����ϵ�д�