题目内容
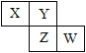
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是
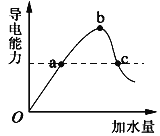
A. 原子半径:Z > Y > XB. 氢化物稳定性:X > Y
C. 氢化物沸点:Z > YD. 最高价氧化物对应的水化物酸性:W > Z
【答案】D
【解析】
Z原子的最外层电子数是第一层电子数的3倍,根据四种元素所在周期表位置,即Z为第三周期,推出Z为S,W为Cl,Y为O,X为N,然后进行分析;
Z原子的最外层电子数是第一层电子数的3倍,根据四种元素所在周期表位置,即Z为第三周期,推出Z为S,W为Cl,Y为O,X为N,
A、同主族从上到下,原子半径增大,同周期从左向右原子半径减小,即原子半径:S>Cl>N>O,故A错误;
B、同周期从左向右非金属性增强,氢化物的稳定性增强,即H2O的稳定性强于NH3,故B错误;
C、H2O分子间存在氢键,H2S不存在分子间氢键,即H2O的沸点高于H2S,故C错误;
D、非金属性越强,其最高价氧化物对应水化物的酸性越强,Cl的非金属性强于S,即HClO4的酸性强于H2SO4,故D正确;
答案选D。

 阶梯计算系列答案
阶梯计算系列答案【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应 2SO2(g) + O2(g)![]() 2SO3(g)(正反应放热),相关数据如下,下列说法正确的是( )
2SO3(g)(正反应放热),相关数据如下,下列说法正确的是( )
容器 1 | 容器 2 | 容器 3 | |
反应温度 T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、 1molO2 | 4molSO3 | 2molSO2、 1molO2 |
平衡ν正(SO2 )/mol·L-1·s-1 | ν1 | ν2 | ν3 |
平衡 c(SO3 )/ mol·L-1 | c1 | c2 | c3 |
平衡体系总压强 p/Pa | p1 | p2 | p3 |
物质的平衡转化率ɑ | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数 K | K1 | K2 | K3 |
A. ν1<ν2,c2<2c1 B. K1>K3,p2>2p3
C. ν1< ν3,α1(SO2) > α3(SO2) D. c2>2c3,α2(SO3) +α3(SO2)<1
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________,直到因加入一滴盐酸后,溶液由________色变为________色,并________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测NaOH 溶液的体积/mL | 0.100 0 mol·L-1 盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据计算该NaOH溶液的物质的量浓度___________。