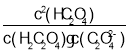题目内容
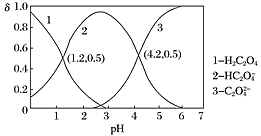
【题目】已知Ka、Kb、Kw、Kh、Ksp分别表示弱酸的电离平衡常数、弱碱的电离平衡常数,水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11
(1)有关上述常数的说法正确的是__________。
a.它们都能反映一定条件下对应变化进行的程度
b.所有弱电解质的电离常数和难溶电解质的Ksp都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,1.0 mol·L-1 HF溶液的pH约等于__________(已知lg2≈0.3)。将浓度相等的HF与NaF溶液等体积混合,判断溶液呈_______(填“酸”、“碱”或“中”)性,并结合有关数据解释原因:_____________。
(3)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的四种溶液:A.NH4Cl,B.NH4SCN,C.CH3COONH4,D.NH4HCO3。回答下列问题:
①试推断NH4HCO3溶液的pH__________7(填“>”、“<”或“=”);
②将四种溶液按NH4+浓度由大到小的顺序排列是:__________(填序号)。
③NH4SCN溶液中所有离子浓度由大到小的顺序为_________。
(4)为探究Mg(OH)2在酸中的溶解性,利用以上数据可以计算出反应:Mg(OH)2(s)+2CH3COOH(aq)![]() Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
Mg2+(aq)+2CH3COO-(aq)+2H2O(l)在25℃时的平衡常数K=________,并据此推断Mg(OH)2_________(填“能”或“不能”)溶解于醋酸。(已知1.83≈5.8)
【答案】ad 1.7 酸 HF和NaF的浓度相等,Ka(HF)=4.0×10-4,NaF溶液中Kh=Kw/Ka=2.5×10-9,所以HF电离程度大于NaF的水解程度,溶液显酸性 > A>B>C>D c(SCN-)> c(NH4+)> c(H+)> c(OH-) ![]() 能
能
【解析】
(1)a. 平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,所以它们都能反映一定条件下对应变化进行的程度,a正确;
b. 难溶电解质Ca(OH)2的Ksp随温度的升高而减小,b错误;
c. 电离平衡常数只与温度有关,温度相同电离平衡常数相同,c错误;
d. 一定温度下,在CH3COONa溶液中, ,所以KW=KaKh,d正确;故答案为:ad;
,所以KW=KaKh,d正确;故答案为:ad;
(2)25℃时,1.0 mol·L-1 HF溶液中,Ka(HF)=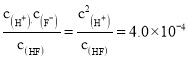 ,c(H+)=2.0×10-2,pH
,c(H+)=2.0×10-2,pH![]() ,HF和NaF的浓度相等,Ka(HF)=4.0×10-4,NaF溶液中Kh=Kw/Ka=2.5×10-9,所以HF电离程度大于NaF的水解程度,溶液呈酸性,故答案为:
,HF和NaF的浓度相等,Ka(HF)=4.0×10-4,NaF溶液中Kh=Kw/Ka=2.5×10-9,所以HF电离程度大于NaF的水解程度,溶液呈酸性,故答案为:![]() 酸; HF和NaF的浓度相等,Ka(HF)=4.0×10-4,NaF溶液中Kh=Kw/Ka=0.25×10-10,所以HF电离程度大于NaF的水解程度,溶液显酸性;
酸; HF和NaF的浓度相等,Ka(HF)=4.0×10-4,NaF溶液中Kh=Kw/Ka=0.25×10-10,所以HF电离程度大于NaF的水解程度,溶液显酸性;
(3)①已知CH3COONH4溶液为中性,说明CH3COO-和NH4+水解程度相同,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,说明酸性:CH3COOH>H2CO3,越弱越水解,可知HCO3-水解程度大于NH4+水解程度,所以NH4HCO3溶液显碱性,pH>7;故答案为:>;
②根据电离平衡常数可知,酸性:HSCN> CH3COOH>H2CO3,越弱越水解,所以四种溶液按NH4+浓度由大到小的顺序:A>B>C>D;故答案为:A>B>C>D;
③酸性:HSCN> CH3COOH ,CH3COO-和NH4+水解程度相同,所以NH4+水解程度大于SCN-水解程度,NH4SCN溶液显酸性,其所有离子浓度由大到小的顺序为:c(SCN-)> c(NH4+)> c(H+)> c(OH-);故答案为:c(SCN-)> c(NH4+)> c(H+)> c(OH-);
(4)在25℃时,平衡常数K=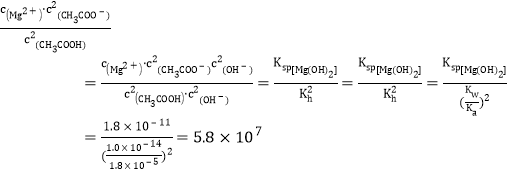 ,据此推断Mg(OH)2能溶解于醋酸,故答案为:
,据此推断Mg(OH)2能溶解于醋酸,故答案为:![]() ;能。
;能。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
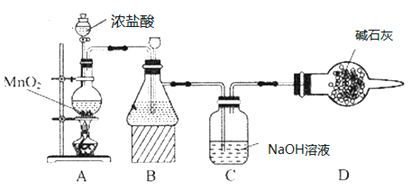
(1)该学习小组按如图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
已知:①饱和NaClO溶液pH为11;②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8。回答下列问题:
①装置B盛装的试剂是___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中C瓶溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的锥形瓶中发生反应的离子方程式为_________。
②滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)