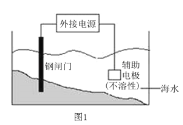
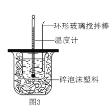
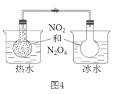
题目内容
【题目】已知草酸为二元弱酸:H2C2O4HC2O4-+H+ Ka1;HC2O4-C2O42-+H+ Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4—、C2O42三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是( )
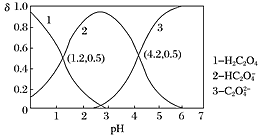
A.pH=1.2的溶液中:c(K+)+c(H+)=c(OH)+c(H2C2O4)
B.pH=2.7的溶液中: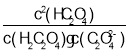 =1000
=1000
C.向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大
D.将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
【答案】D
【解析】
A.根据图像,pH=1.2时,H2C2O4、HC2O4的物质的量分数相等,且c(K+)+c(H+)=c(OH)+c(HC2O4),则c(K+)+c(H+)=c(OH)+c(H2C2O4),故A正确;
B.由图象可知pH=1.2时,c(H2C2O4)=c(HC2O4),则Ka1=c(H+)=101.2,pH=4.2时,c(HC2O4)=c(C2O42),Ka2=c(H+)=104.2,由电离常数可知 =
=![]() =1000,故B正确;
=1000,故B正确;
C.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液仍为酸性,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,故C正确;
D.将相同物质的量KHC2O4和K2C2O4固体完全溶于水,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为4.2,故D错误;
答案选D。

 中考解读考点精练系列答案
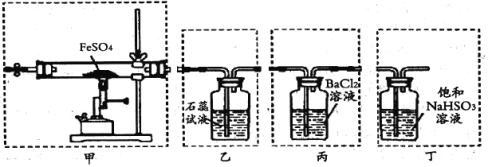
中考解读考点精练系列答案【题目】目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。
实验Ⅰ:确定硫的质量:
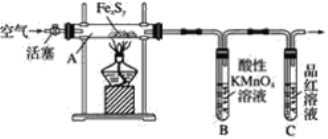
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50mL0.100mol·L-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后,将B中溶液转移至250mL 容量瓶,洗涤试管B后定容。取25.00mL该溶液用0.01mol·L-1的草酸(H2C2O4)溶液滴定剩余的KMnO4。记录数据如下:
滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.50 | 23.70 |
2 | 25.00 | 1.02 | 26.03 |
3 | 25.00 | 0.00 | 24.99 |
相关反应:①2MnO4-+2H2O+5SO2=2Mn2++5SO42-+4H+
②2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O
实验Ⅱ:确定铁的质量:
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6g固体 。
试回答下列问题:
(1)判断滴定终点的方法是__。
(2)试管C中品红溶液的作用是__。有同学提出,撤去C装置对实验没有影响,你的看法是__(选填“同意”或“不同意”),理由是__。
(3)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为__。