题目内容
1.工业上利用镍废料(含镍和铁)生产氯化镍(NiCl2•6H2O)的工艺流程如下图所示
请回答下列问题:
(1)Ni和稀HNO3反应生成Ni(NO3)2的化学方程式3Ni+8HNO3=3Ni(NO3)2+2NO↑+4H2O.
(2)将分离出的碳酸镍沉淀用自来水反复洗涤,直至洗到硫酸根离子合格为止,请写出实验室洗涤沉淀的操作方法向有滤渣的漏斗中注入蒸馏水至水面没过滤渣,待水自然流完后,重复几次,至最后一次流出的洗涤液合格为止.
(3)已知盐酸酸化后溶液中含有少量Fe2+,请写出加入双氧水后反应的离子方程式3H2O2+2Fe2++2H+=2Fe3++4H2O+O2↑.
(4)流程中的操作1是蒸发浓缩,操作2是冷却结晶.
(5)分离母液中含有大量的Na2SO4,可经处理后回收.
分析 工业上用镍废料(含镍和铁)制取氯化镍(NiCl2•6H2O),将镍废料加入硝酸和硫酸溶解后过滤得到滤液中可能含有铁离子、镍离子、亚铁离子,加入碳酸钠溶液调节溶液的PH,使铁离子全部沉淀,过滤后的滤液在加入盐酸酸化,再加双氧水将溶液中少量的亚铁离子氧化成铁离子,经过净化得氯化镍和硫酸钠的混合溶液,通过蒸发浓缩,冷却结晶可得NiCl2•6H2O,同时母液中有大量的Na2SO4可回收再利用,据此答题.
解答 解:工业上用镍废料(含镍和铁)制取氯化镍(NiCl2•6H2O),将镍废料加入硝酸和硫酸溶解后过滤得到滤液中可能含有铁离子、镍离子、亚铁离子,加入碳酸钠溶液调节溶液的PH,使铁离子全部沉淀,过滤后的滤液在加入盐酸酸化,再加双氧水将溶液中少量的亚铁离子氧化成铁离子,经过净化得氯化镍和硫酸钠的混合溶液,通过蒸发浓缩,冷却结晶可得NiCl2•6H2O,同时母液中有大量的Na2SO4可回收再利用,
(1)Ni和稀HNO3反应生成Ni(NO3)2的反应是氧化还原反应,根据氧化还原反应中电子得失守恒可知,Ni和稀HNO3反应生成Ni(NO3)2的化学方程式为3Ni+8HNO3=3 Ni(NO3)2+2NO↑+4H2O,
故答案为:3Ni+8HNO3=3 Ni(NO3)2+2NO↑+4H2O;
(2)实验室洗涤沉淀的操作方法是向有滤渣的漏斗中注入蒸馏水至水面没过滤渣,待水自然流完后,重复几次,至最后一次流出的洗涤液合格为止,
故答案为:向有滤渣的漏斗中注入蒸馏水至水面没过滤渣,待水自然流完后,重复几次,至最后一次流出的洗涤液合格为止;
(3)酸性条件下双氧水能将Fe2+氧化成Fe3+,反应的离子方程式为3H2O2+2Fe2++2H+=2Fe3++4H2O+O2↑,
故答案为:3H2O2+2Fe2++2H+=2Fe3++4H2O+O2↑;
(4)根据上面的分析可知,流程中的操作1是蒸发浓缩,操作2是冷却结晶,
故答案为:蒸发浓缩;冷却结晶;
(5)根据上面的分析可知,分离母液中含有大量的 Na2SO4,
故答案为:Na2SO4.
点评 本题考查了流程分析推断,实验操作步骤的分析判断,化学方程式计算和电解原理分析应用,题目综合性较大,难度中等.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 同一溶液中溶质的物质的量浓度一定,故溶质的物质的量不会随体积变化而变化 | |
| B. | 将0.73g HCl通入到200mL蒸馏水中配成稀盐酸,c(HCl)≠0.1mol/L | |
| C. | 浓溶液在稀释过程中存在如下规律:c(浓)•V(浓)>c(稀)•V(稀) | |
| D. | 某溶液中溶质的质量分数为w%,溶液的密度为ρ g•cm-3,溶质的摩尔质量为M g•mol-1,则该溶液中溶质的物质的量浓度为c=$\frac{1000ρw}{M}$mol/L |
①汞②液氨③氯化钠④盐酸⑤干冰⑥蔗糖⑦氯化银.
| A. | ①③④ | B. | ③⑦ | C. | ②③④ | D. | ⑤⑥ |
| A. | 同温同压下,等质量的SO2和CO2相比较,体积比为11:16 | |
| B. | 22.4LCH4的质量与NA个甲烷分子的质量之和相等 | |
| C. | 标准状况下,28gCO与N2的混合气体的体积约为22.4L | |
| D. | 标准状况下,22.4LCH4和氧气的混合物所含的分子数为NA |
| A. | Al3+、NO3-、K+、SO42- | B. | Cu2+、Ba2+、SO42-、CO32- | ||
| C. | OH-、Cl-、NH4-、Na+ | D. | Mg2+、Na+、SO42-、NO3- |
| A. | 铜丝在空气中灼烧后迅速伸入乙醇蒸气中 | |
| B. | 铁粉与硫粉物质的量之比为1:1时混合加热 | |
| C. | 锌粉加入到氯化铜溶液中 | |
| D. | 去除氧化膜的铝条插入到浓硝酸中 |
| A. |  的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 有机物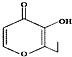 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 | |
| C. | 布洛芬结构如图所示 该物质可发生氧化、还原、加成、消去、取代反应 该物质可发生氧化、还原、加成、消去、取代反应 | |
| D. | 经测定乙二醇和苯组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是84% |
 硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.
硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措.