题目内容
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
C
解析试题分析:氨气分子空间构型是三角锥形,而甲烷是正四面体形,是因为在氨气分子中N原子的杂化方式sp3型杂化,在N原子上有一对孤对电子,它对成键电子的排斥作用较强,而在CH4分子中C原子也是sp3型杂化,但是因为没有孤对电子的排斥作用,形成了四个共价键,均匀排布,因此CH4分子正四面体形。故选项为C。
考点:考查氨气分子与甲烷的空间构型不同的原因的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物品中,都用到硅单质的是
①陶瓷 ②硅太阳能电池 ③玛瑙 ④计算机芯片 ⑤光导纤维
| A.①③⑤ | B.②④ | C.③④ | D.②③⑤ |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是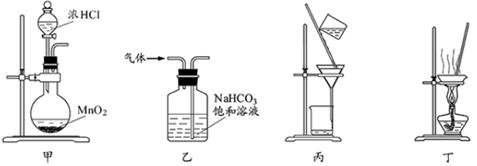
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O |
下列陈述Ⅰ、Ⅱ均正确且有因果关系的是:( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 动物油脂相对不容易被氧化 | 油脂工业通常要将液态油脂氢化 |
| B | HNO3具有酸的通性 | 硝酸常用作金属铜加工前的酸洗 |
| C | 明矾可以净水 | 浑浊的石灰水加入明矾会变澄清 |
| D | Si是一种非金属单质 | 单质Si能与NaOH溶液反应 |
下列说法正确的是
| A.煤的干馏、石油的分馏都是物理变化 |
| B.工业上常用澄清石灰水和氯气反应制漂白粉 |
| C.蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析” |
| D.二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路” |
基于实验现象的推论,你认为合理的是( )
| 选项 | 实验现象 | 推论 |
| A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
| B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
| C | 氨气用于喷泉实验 | 氨气极易溶于水 |
| D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
设法把NO2和O2按4:1体积比充满一干燥的真空烧瓶中,然后把烧瓶置于水中,瓶内液面会逐渐上升,则最终烧瓶中所得溶液的物质的量浓度为(假设①气体体积为标准状况下测定 ②烧瓶中溶液不向外扩散)
| A.1/14mol /L | B.1/22.4mol/L | C.1/28mol/L | D.1/42mol/L |
下列实验的现象与对应结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |