题目内容
下列陈述Ⅰ、Ⅱ均正确且有因果关系的是:( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 动物油脂相对不容易被氧化 | 油脂工业通常要将液态油脂氢化 |
| B | HNO3具有酸的通性 | 硝酸常用作金属铜加工前的酸洗 |
| C | 明矾可以净水 | 浑浊的石灰水加入明矾会变澄清 |
| D | Si是一种非金属单质 | 单质Si能与NaOH溶液反应 |
A
解析试题分析:动物油脂是饱和油脂呈固态,不容易被氧化,而液态油脂通常含有不饱和键,易被氧化,因此需要加氢生成饱和油脂,A正确;硝酸有酸的通性,但是硝酸还具有强氧化性,能和金属铜反应,因此不能用于金属铜加工前的酸洗,B错误;明矾净水是氢氧化铝吸附作用,而浑浊石灰水加入明矾中变澄清,是因为生成的氢氧化铝又继续溶解于强碱中的原因,故C错误;D中关于硅元素的描述前后无因果关系,D错误;故选A。
考点:本题考查的是元素及其化合物的性质和联系。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
“绿色化学”又称环境无害化学、环境友好化学、清洁化学,某化学课外小组利用废铜制取硫酸铜,设计了如下制取方案,其中符合“绿色化学”要求的是( )
A.Cu CuSO4 CuSO4 |
B.Cu CuSO4 CuSO4 |
C.Cu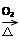 CuO CuO CuSO4 CuSO4 |
D.Cu Cu(NO3)2 Cu(NO3)2 Cu(OH)2 Cu(OH)2 CuSO4 CuSO4 |
下列叙述中正确的是
| A.酚类中加入浓溴水一定能产生白色沉淀 |
| B.氮化硅陶瓷属于无机非金属材料 |
| C.浓硝酸存放于带橡胶塞的棕色细口瓶中 |
| D.淀粉和纤维素的分子式都是(C6H10O5)n |
物质的量之比为2︰5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
| A.1︰4 | B.1︰5 | C.2︰3 | D.2︰5 |
下列关于卤素的叙述,错误的是( )
| A.单质的颜色随核电荷数的增加逐渐加深 |
| B.单质的氧化性随核电荷数的增加而减弱 |
| C.F2通入NaCl水溶液中反应,生成NaF和Cl2 |
| D.可用硝酸酸化的硝酸银溶液来鉴别Cl—、Br— 、I—离子 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
下列图象描述正确的是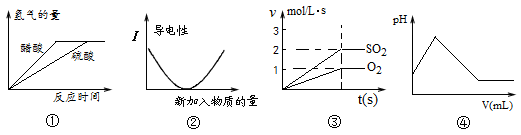
| A.图①表示体积和PH值均相同的稀硫酸和醋酸,和足量的镁反应生成H2量的关系 |
| B.图②表示向氨水中滴加醋酸,溶液导电性变化的关系 |
C.图③表示2SO2(g)+O2(g) 2SO3(g)反应中,SO2和O2反应速率大小关系 2SO3(g)反应中,SO2和O2反应速率大小关系 |
| D.图④表示向H2S中通入Cl2时,溶液的pH大小变化关系 |
下列关于氯水的说法正确的是( )
| A.向氯水中通入少量二氧化硫,氯水的漂白性增强 |
| B.氯水中加入NaCl固体,对溶液的pH无影响 |
| C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O |