题目内容
【题目】![]() 是食品加工中最为快捷的食品添加剂,用于焙烤食品;
是食品加工中最为快捷的食品添加剂,用于焙烤食品; ![]() 在分析试剂、医药、电子工业中用途广泛
在分析试剂、医药、电子工业中用途广泛![]() 请回答下列问题:
请回答下列问题:
(1)![]() 可作净水剂,其原理是 ______
可作净水剂,其原理是 ______ ![]() 用必要的化学用语和相关文字说明
用必要的化学用语和相关文字说明![]() .
.
(2)相同条件下, ![]() 的
的![]() 中
中![]() ______
______ ![]() 填“等于”、“大于”或“小于”
填“等于”、“大于”或“小于”![]() 中
中![]()
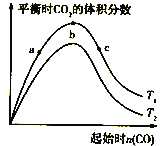
(3)均为![]() 的几种电解质溶液的pH随温度变化的曲线如图1所示.
的几种电解质溶液的pH随温度变化的曲线如图1所示.
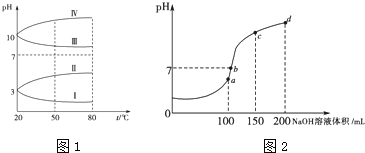
①其中符合![]()
![]() 的pH随温度变化的曲线是 ______ ,导致pH随温度变化的原因是 ______ ;
的pH随温度变化的曲线是 ______ ,导致pH随温度变化的原因是 ______ ;
②![]() 时,
时, ![]() 的
的![]()
![]() 中
中![]() ___ mol/L
___ mol/L
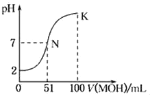
(4)室温时,向100mL![]() 溶液中滴加
溶液中滴加![]() 溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是 ______ .
溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是 ______ .
【答案】 ![]() 水解生成的
水解生成的![]() 具有吸附性,即
具有吸附性,即![]() 吸附悬浮颗粒使其沉降从而净化水 小于 Ⅰ
吸附悬浮颗粒使其沉降从而净化水 小于 Ⅰ ![]() 水解,溶液呈酸性,升高温度,其水解程度增大,pH减小 10-3 a
水解,溶液呈酸性,升高温度,其水解程度增大,pH减小 10-3 a ![]()
【解析】本题主要考查水的电离平衡、弱酸电离、盐类水解等。
(1)![]() 可作净水剂,其原理是Al3++3H2O
可作净水剂,其原理是Al3++3H2O![]() Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水.
Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水.
(2)![]() 中Al3+与
中Al3+与![]() 水解互促,
水解互促, ![]() 中H+抑制
中H+抑制![]() 水解,所以相同条件下,
水解,所以相同条件下, ![]() 的
的![]() 中
中![]() 小于
小于![]() 中
中![]()
(3)①其中符合![]()
![]() 的pH随温度变化的曲线是I ,导致pH随温度变化的原因是
的pH随温度变化的曲线是I ,导致pH随温度变化的原因是![]() 水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
②![]() 时,
时, ![]() 的
的![]()
![]() 中电荷守恒:
中电荷守恒: ![]() ,所以
,所以= (
![]() )mol/L≈
)mol/L≈![]() mol/L.
mol/L.
(4)a、b、c、d四个点,a点时加入100mLNaOH溶液,中和反应恰好完全进行,形成硫酸铵和硫酸钠的混合溶液, ![]() 的水解促进水的电离,b点
的水解促进水的电离,b点![]() 电离的H+或抑制水的电离,c、d点生成的NH3
电离的H+或抑制水的电离,c、d点生成的NH3![]() H2O抑制水的电离,因此,水的电离程度最大的是a点;在b点,H++OH-
H2O抑制水的电离,因此,水的电离程度最大的是a点;在b点,H++OH-![]() H2O完全进行,
H2O完全进行, ![]() +OH-
+OH-![]() NH3·H2O部分进行,溶液中存在Na2SO4、(NH4)2SO4、NH3
NH3·H2O部分进行,溶液中存在Na2SO4、(NH4)2SO4、NH3![]() H2O等,各离子浓度由大到小的排列顺
H2O等,各离子浓度由大到小的排列顺![]() .
.

 智能训练练测考系列答案
智能训练练测考系列答案【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
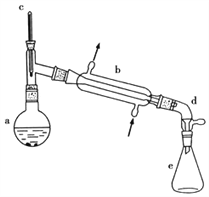

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
(1)合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
(2)分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_________(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________
(4)在本实验的分离过程中,产物应从分液漏斗的_________________(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是________________________
(6)在蒸馏收集产品时, 控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______________(填序号)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
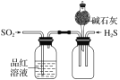
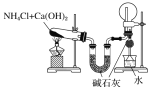
【题目】下列有关实验装置及实验方案的设计不正确的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验设计 | 探究SO2的氧化性和漂白性 | 实验室制氨气并收集干燥的氨气 | 验证苯中是否有碳碳双键 | 用乙醇提取溴水中的Br2 |
A. A B. B C. C D. D
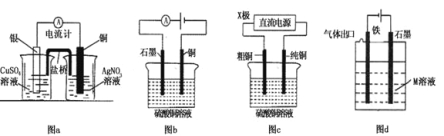
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
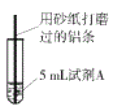
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
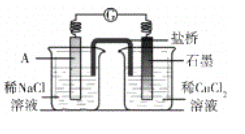
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。