题目内容
下列装置能达到相应的实验目的的是
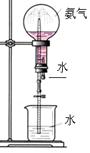
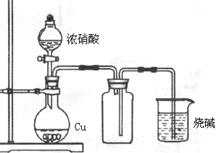


| A.氨气溶于水的喷泉实验 | B.铜和浓硝酸制备NO2气体 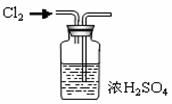 |
| C.加热氯化铵制备氨气 | D.用浓硫酸干燥氯气 |
AB
略

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
题目内容


| A.氨气溶于水的喷泉实验 | B.铜和浓硝酸制备NO2气体  |
| C.加热氯化铵制备氨气 | D.用浓硫酸干燥氯气 |

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案