题目内容
叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
| A.NaN3中只含有离子键 |
| B.1molNaN3完全分解最多可以产生33.6LN2 |
| C.NaN3快速分解时,NaN3既是氧化剂,又是还原剂 |
| D.常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
C
试题分析:NaN3是Na+和N3—构成的离子化合物,N3—中氮元素与氮元素之间还存在共价键,故A选项错误;依题意可得:2NaN3
 2Na+3N2↑,由于其中N2与NaN3的系数之比等于物质的量之比,则1mol NaN3完全分解最多可以产生1.5molN2,由于缺少温度和压强,气体摩尔体积不一定是22.4L/mol,则氮气的体积不一定是33.6L,故B选项错误;由于2NaN3
2Na+3N2↑,由于其中N2与NaN3的系数之比等于物质的量之比,则1mol NaN3完全分解最多可以产生1.5molN2,由于缺少温度和压强,气体摩尔体积不一定是22.4L/mol,则氮气的体积不一定是33.6L,故B选项错误;由于2NaN3 2Na+3N2↑中钠元素化合价降低,氮元素化合价升高,则NaN3既是氧化剂又是还原剂,故C选项正确;由于NaN3在高温或剧烈震动能够发生强烈爆炸,因此需要说明安全警示标志,故D选项错误。
2Na+3N2↑中钠元素化合价降低,氮元素化合价升高,则NaN3既是氧化剂又是还原剂,故C选项正确;由于NaN3在高温或剧烈震动能够发生强烈爆炸,因此需要说明安全警示标志,故D选项错误。
练习册系列答案
相关题目

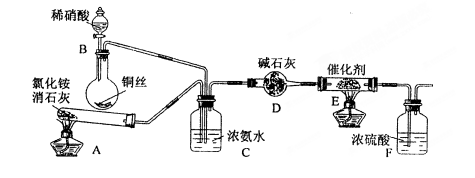
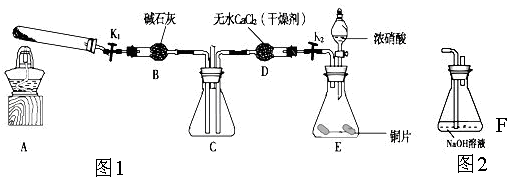
 。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):