题目内容
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 |
| B.由C(石墨)= C(金刚石) △H=+1.90 kJ/mol可知,金刚石比石墨稳定 |
| C.在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: 2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ/mol |
| D.在稀溶液中,H+(aq)+ OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ |
D
解析试题分析:A、固体硫的总能量低于气态硫的总能量,所以等物质的量的硫蒸气和固体硫分别完全燃烧,前者放出热量多,A不正确;B、由C(石墨)= C(金刚石) △H=+1.90 kJ/mol可知,金刚石的总能量高于石墨的总能量。能量越低越稳定,所以石墨比金刚石稳定,B不正确;C、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的能量,2g氢气的物质的量是1mol,所以在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:H2(g)+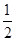 O2(g)=H2O(l) △H=-285.8kJ/mol,C不正确;D、中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。浓硫酸溶于水放热,因此在稀溶液中,H+(aq)+ OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ,D正确,答案选D。
O2(g)=H2O(l) △H=-285.8kJ/mol,C不正确;D、中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。浓硫酸溶于水放热,因此在稀溶液中,H+(aq)+ OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ,D正确,答案选D。
考点:考查反应热、中和热、燃烧热的有关判断和应用

 阅读快车系列答案
阅读快车系列答案S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)=SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)=SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)=S(正交,s) ΔH3
下列说法正确的是( )
| A.ΔH3=+0.33 kJ·mol-1 |
| B.单斜硫转化为正交硫的反应是吸热反应 |
| C.S(单斜,s)=S(正交,s) ΔH3<0,正交硫比单斜硫稳定 |
| D.S(单斜,s)=S(正交,s) ΔH3>0,单斜硫比正交硫稳定 |
.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq) +OH-(aq)═H2O(l)
△H = -57.3kJ/mol。分别向1L 0.5mol/L的Ba(OH)2的溶液中加入①浓硫酸;② 稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
| A.△H1<△H2=△H3 | B.△H1>△H2>△H3 |
| C.△H1>△H2=△H3 | D.△H1=△H2<△H3 |
下列关于能量转换的认识中不正确的是
| A.原电池工作时化学能全部转化为电能 |
| B.工业上电解氧化铝制备铝,电能转化成化学能 |
| C.镁在空气中燃烧时化学能不只转变成热能 |
| D.绿色植物光合作用过程中太阳能转变成化学能 |
在下列各说法中,正确的是( )
A.对于2SO2(g)+O2(g)  2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ |
| B.热化学方程式中的化学计量数不能用分数表示 |
| C.Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能 |
| D.ΔH的大小与热化学方程式的化学计量数无关 |
下列关于化学反应与能量的说法正确的是( )
| A.化学反应中一定有物质变化但不一定有能量变化 |
B.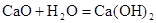 是放热反应,说明CaO的能量大于 是放热反应,说明CaO的能量大于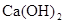 的能量 的能量 |
C.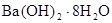 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 |
| D.由H2→2H的过程需要吸收能量 |
下列反应属于吸热反应的是
| A.葡萄糖在人体内氧化分解 | B.氢气在氧气中燃烧 |
| C.氢氧化钡晶体与氯化铵晶体反应 | D.氢氧化钾和硫酸中和 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH3OH(g) + H2O(g) → CO2(g) + 3H2(g) – 49.0 kJ
下列说法正确的是
| A.1 LCH3OH蒸汽与1 L水蒸汽反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ |
| B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量 |
| C.相同条件下1molCH3OH(g)与1mol H2O(g)的能量总和小于1molCO2(g)与3 mol H2(g)的能量总和 |
| D.1 molCH3OH蒸汽与1 mol液态水反应生成1mol CO2气体与3 mol 氢气吸收的热量小于49.0 kJ |
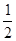 O2(g)═CO(g) ; △H2
O2(g)═CO(g) ; △H2