题目内容

某有机物A的相对分子质量为198.5,A跟氯气反应,在铁粉存在下只有一个氢原子被取代时能得到两种有机产物,而在光照下只有一个氢原子被取代时,只能得到一种有机产物;A跟NaHCO3反应,产生使石灰水变浑浊的无色气体;A在NaOH存在下水解后的溶液用硝酸酸化,再加入硝酸银溶液,会立即生成白色沉淀.

A在一定条件下可发生下列一系列反应,最终生成D和F;
(1)写出下列物质的结构简式:
A:


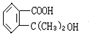
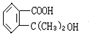




(2)指出下列变化的反应类型:①A→B:
 ;
;由A→B在氢氧化钠水溶液、加热条件下进行,发生卤代烃的水解反应及中和反应,故B为
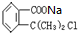 ,由B
,由B| H+ |
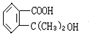 ,由C→D发生脱水反应,生成高分子化合物D,应为酯化反应,故D为
,由C→D发生脱水反应,生成高分子化合物D,应为酯化反应,故D为 ;由C
;由C| 浓硫酸 |
| -H2O |
| 催化剂 |
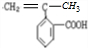 ,F为
,F为 .
. ;
;由A→B在氢氧化钠水溶液、加热条件下进行,发生卤代烃的水解反应及中和反应,故B为
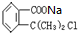 ,由B
,由B| H+ |
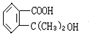 ,由C→D发生脱水反应,生成高分子化合物D,应为酯化反应,故D为
,由C→D发生脱水反应,生成高分子化合物D,应为酯化反应,故D为 ;由C
;由C| 浓硫酸 |
| -H2O |
| 催化剂 |
 ,F为
,F为 ,
,(1)由上述分析可知,A为
 ,C为
,C为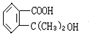 ,D为
,D为 ,F为
,F为 ;
;故答案为:
 ;
;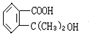 ;
; ;
; ;
;(2)反应①A→B属于取代反应; ②反应C→D属于缩聚反应; ③反应C→E属于消去反应,
故答案为:取代反应;缩聚反应;消去反应.

苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
![]()
![]()
![]() CH3 + 2KMnO4 Δ COOK + KOH + 2MnO2 + H2O
CH3 + 2KMnO4 Δ COOK + KOH + 2MnO2 + H2O
![]()
![]()
![]() COOK + HCl COOH + KCl
COOK + HCl COOH + KCl
|
|
|
|
|
|
|
|
| |||||
|
|
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是
。
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请在答题卡上完成表中内容。
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解,
| 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl— |
| ③ | 干燥白色晶体, |
| 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10—3mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。
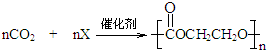 ,则X的结构简式为
,则X的结构简式为
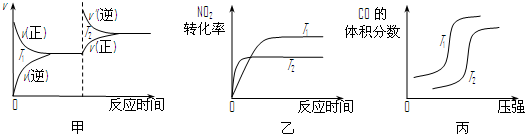
 CO2(g) +H2(g) △H=-42KJ/mol
CO2(g) +H2(g) △H=-42KJ/mol 
