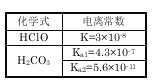
题目内容
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 2.0gH218O与D2O的混合物中所含中子数为NA
B. 50mL18mol·L-1浓硫酸与足量铜供热,转移电子数为0.9NA
C. 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴离子数为0.2NA
D. 标准状况下,2.24LNO和足量O2反应生成物中含有NO2分子数为0.1NA
【答案】A
【解析】A、H218O与D2O摩尔质量为20g·mol-1,1mol该物质含有中子的物质的量分别是10mol、10mol,因此2g混合物含有中子的物质的量为2×10/20mol=1mol,故A正确;B、铜只跟浓硫酸反应,随着反应的进行,浓硫酸浓度降低,到达某一浓度反应将会停止,因此转移电子物质的量小于0.9mol,故B错误;C、还原性:Fe2+>Br-,氯气先与Fe2+反应,2Fe2++Cl2=2Fe3++2Cl-,0.1molFe2+反应消耗0.05molCl2,氯气过量,再与Br-反应,2Br-+Cl2=2Cl-+Br2,0.1molFeBr2的物质的量为0.2molBr-,消耗氯气0.1mol,0.05molCl2不足,氯气全部参与反应,消耗Br-的物质的量为0.1mol,故C错误;D、2NO+O2=2NO2,反应中存在2NO2![]() N2O4,因此NO2的物质的量小于0.1mol,故D错误。
N2O4,因此NO2的物质的量小于0.1mol,故D错误。

 阅读快车系列答案
阅读快车系列答案【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与Cl2合成,回答下列问题:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及热化学方程式和平衡常数如下表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+ Cl2(g) | K3 |
则ΔH3=_________(用ΔH1、ΔH2表示);K3=__________(用K1、K2 表示)
(2)300℃时,在一密闭容器中发生反应:2ClNO(g) ![]() 2NO(g)+ Cl2(g),其正反应速率表达式为v正=k·cn(ClNO)。测得速率和浓度的关系如下表:
2NO(g)+ Cl2(g),其正反应速率表达式为v正=k·cn(ClNO)。测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | v正/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
/p>
则n=________;k=___________;达到平衡后,若减小压强,则混合气体的平均分子量将_______(填“增大”、“减小”或“不变”)。
(3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08mol NO和0.04mol Cl2发生反应:2NO(g)+Cl2(g) ![]() 2ClNO(g) ΔH
2ClNO(g) ΔH
①若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图Ⅰ曲线a所示,则ΔH________0(填“>”、“<”或“不确定”);若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图Ⅰ曲线b所示,则改变的条件是___________。
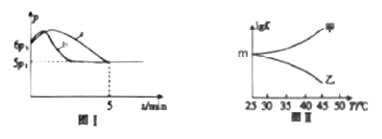
②图Ⅱ是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”);m值为_______________。