题目内容
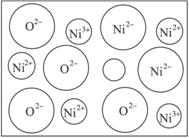
(1)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如下图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。?

解析:(1)因为NiO的晶体结构与NaCl的晶体结构相同,均为正方体。从晶体结构模型中分割出一个小立方体,其中小立方体的边长为Ni2+与最邻近O2-的核间距离即a×10
Ni2+:![]() ,含O2-:
,含O2-: ![]() ,
,
所以( ![]() ×10-8)3×NA cm3是0.5 mol NiO具有的体积,则(
×10-8)3×NA cm3是0.5 mol NiO具有的体积,则(![]() ×10-8)-3NA cm3×ρ=0.5 mol×
×10-8)-3NA cm3×ρ=0.5 mol×![]() g·cm-3=
g·cm-3=![]() g·cm-3。解题的关键是确定晶胞的组成后,通过晶体组成计算出存在的微粒数。?
g·cm-3。解题的关键是确定晶胞的组成后,通过晶体组成计算出存在的微粒数。?
(2)设1 mol Ni0.97O中,含有Ni3+![]() mol,Ni2+为(0.97-
mol,Ni2+为(0.97-![]() )mol,根据晶体显电中性,即3
)mol,根据晶体显电中性,即3![]() mol+2(0.97-
mol+2(0.97-![]() )mol=2×1 mol,解得
)mol=2×1 mol,解得![]() =0.06,Ni2+为(0.97-
=0.06,Ni2+为(0.97-![]() )mol=0.91 mol,则离子数之比为Ni3+∶Ni2+=0.06∶0.91=6∶91。?
)mol=0.91 mol,则离子数之比为Ni3+∶Ni2+=0.06∶0.91=6∶91。?
答案:(1)![]() g·cm-3或
g·cm-3或![]() g·cm-3??
g·cm-3??
(2)6∶91

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体. NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).
(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体. NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).