题目内容
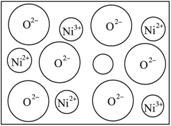
(1)中学教材上所示的NaCl晶体结构,它向三维空间延伸,得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g·mol-1)。
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。其氧化镍样品组成为Ni0.97O,试计算该晶体中Ni2+与Ni3+的离子数之比。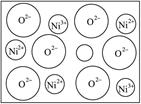
【答案】
(1)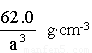 (2)6∶91
(2)6∶91
【解析】
试题分析:(1)1 cm3中阴、阳离子总数=[1.00 cm/(a×10-8)cm]3
1 cm3中Ni2+—O2-离子对数=[1.00 cm/(a×10-8)cm]3×(1/2)
密度=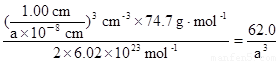 g·cm-3。
g·cm-3。
(2)设1 mol Ni0.97O中含Ni3+x mol,Ni2+(0.97-x) mol;根据电中性:3x mol+2(0.97-x) mol=2×1 mol x="0.06" Ni2+为(0.97-x) mol="0.91" mol,离子数之比:Ni3+∶Ni2+=0.06∶0.91=6∶91。
考点:考查晶体结构的应用、计算
点评:该题是高考中的常见题型,综合性强,难度大,学生不易得分。该题主要是考查学生分析问题、解决问题的能力。有助于培养学生的逻辑思维能力、发散思维能力和抽象思维能力,也有利于培养学生的规范答题能力,提高学生应试能力和学习效率。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
 (1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体. NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).
(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体. NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).