题目内容
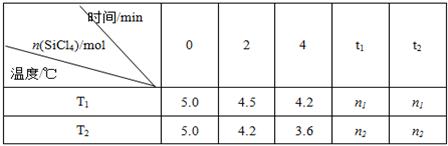
(14分)高纯硅是当今科技的核心材料。工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl4(g)+2H2(g) Si(s)+4HCl(g)。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g)。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: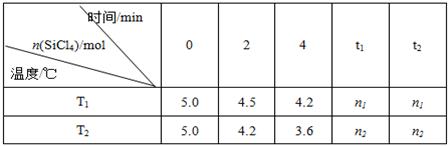
(1)T1时,反应开始的2 min内,用HCl表示的反应速率为 。
(2)该反应的平衡常数表达式为:K= 。
(3)保持其他条件不变,下列措施可提高SiCl4转化率的是 。
a.充入更多的SiCl4(g)
b.充入更多的H2(g)
c.及时分离出Si(s)
d.使用催化剂
e.将容器的体积扩大一倍
(4)据上表中的数据分析:T1 T2(填“>”或“<”,下同),理由是 。已知n1>n2,ΔH 0。
(5)有同学认为,采用水淋法来吸收生成的HCl,可以提高SiCl4的转化率。该认识 (填“合理”或“不合理”),理由是 。
(6)将平衡后的混合气体溶于水,取少量上层清液,向其中滴加足量的AgNO3溶液,反应后过滤,取沉淀向其中加入Na2S溶液,可观察到 。
(14分)
(1)1.0 mol/(L ? min)(2分) (2)(2分)
(3)be (2分)
(4)< (1分) T2时反应速率快(2分)> (1分)
(5)不合理(1分) SiCl4遇水完全水解生成硅酸和盐酸(2分)
(6)白色沉淀转化为黑色沉淀(1分)
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: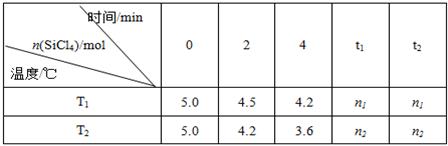
 Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: