题目内容
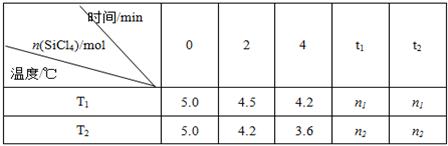
(14分)高纯硅是当今科技的核心材料。工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl4(g)+2H2(g) Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
(1)T1时,反应开始的2 min内,用HCl表示的反应速率为 。
(2)该反应的平衡常数表达式为:K= 。
(3)保持其他条件不变,下列措施可提高SiCl4转化率的是 。
a.充入更多的SiCl4(g)
b.充入更多的H2(g)
c.及时分离出Si(s)
d.使用催化剂
e.将容器的体积扩大一倍
(4)据上表中的数据分析:T1 T2(填“>”或“<”,下同),理由是 。已知n1>n2,ΔH 0。
(5)有同学认为,采用水淋法来吸收生成的HCl,可以提高SiCl4的转化率。该认识 (填“合理”或“不合理”),理由是 。
(6)将平衡后的混合气体溶于水,取少量上层清液,向其中滴加足 量的AgNO3溶液,反应后过滤,取沉淀向其中加入Na2S溶液,可观察到 。
(14分)
(1)1.0 mol/(L • min)(2分) (2)(2分)
(3)be (2分)
(4)< (1分) T2时反应速率快 (2分)> (1分)
(5)不合理 (1分) SiCl4遇水完全水解生成硅酸和盐酸 (2分)
(6)白色沉淀转化为黑色沉淀 (1分)
解析:(1)在T1时,反应开始的2 min内消耗的SiCl4的量是0.5mol,所以生成的HCl的量是2.0mol。因此用HCl表示的反应速率为1.0 mol/(L • min)。
(2)平衡常数是指在一定条件下,可逆反应达到平衡是生成物浓度的幂之积和反应物浓度的幂之积的比值。根据方程式可写出该反应的平衡常数表达式,需要注意的是在表达式中不能出现固体或纯液体的。
(3)因为这是一个体积增大的可逆反应,因此将容器的体积扩大一倍,平衡向正反应方向移动,增大反应物的转化率,e正确。充入更多的SiCl4(g),平衡虽然向正反应方向移动,但会降低自身的转化率,而提高氢气的转化率,所以a不正确,b正确。Si(s)是固体不影响平衡,c不正确。催化剂能同等程度改变正逆反应速率,但不会影响平衡,但不正确。故正确的答案是be。
(4)根据表中数据可知在相同时间内温度为T2反应速率快,因为温度越高,速率越快,故T2大于T1。n1>n2说明前者的转化率低于后者,即温度越高反应物的转化率越大,所以正反应是吸热反应。即ΔH大于0。
(5)由于SiCl4遇水完全水解生成硅酸和盐酸,所以采用水淋法来吸收生成的HCl是错误的。
(6)平衡后的混合气体溶于水,所得溶液中含有盐酸,滴加AgNO3溶液将生成AgCl沉淀,过滤后向沉淀中加入Na2S溶液,则沉淀颜色将由白色转化为黑色,这是因为Ag2S比AgCl更难溶,沉淀将向生成更难溶的物质转化。

 Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: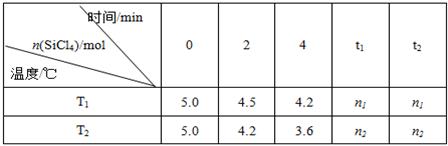
 Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g) 。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: