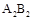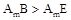题目内容
甲、乙、丙、丁为4种短周期元素,在周期表中,甲与乙、丙、丁在周期表中的位置关系如图所示(原子序数:乙>丙)。丁的原子序数与乙、丙原子序数之和相等,4种元素原子的最外层电子数之和为24。下列判断正确的是 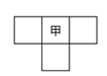
| A.元素甲的简单气态氢化物稳定性比乙的强 |
| B.元素丁在周期表中的位置为第3周期,VIA族 |
| C.元素丙和元素丁的最高价氧化物对应的水化物均为强酸 |
| D.4种元素的简单阴离子半径从大到小顺序为:丁>乙>丙>甲 |
BC
解析试题分析:根据题目信息推出甲为O,丁为S,乙为F,丙为N,A、乙和甲处于同一周期,从左到右非金属性增强,所以元素甲的简单气态氢化物稳定性比乙的弱,错误;D、四种元素的原子半径正确顺序为丁>丙>甲>乙,错误;
考点:考查元素周期表中位构性三者间的相互关系。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是
| A.化合物XZW既含离子键也含共价键 |
| B.对应气态氢化物的稳定性Y>Z |
| C.对应简单离子半径:X>W |
| D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
短周期元素T、X、Y、Z的原子序数依次增大,T与Z属于同一主族,X、Y、Z最高价氧化物对应的水化物两两之间都能反应,且X、Y、Z原子最外层电子数之和等于X的原子序数。则下列说法正确的是
| A.简单离子半径大小顺序:rT>rX>rY |
| B.T与Z的最高正化合价相等 |
| C.室温下,单质Y不能与浓硫酸反应 |
| D.用电解法可制得T、X、Y的单质 |
元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是
| A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
B.某微粒的结构示意简图为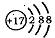 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 |
| C.Be(OH)2的碱性比Mg(OH)2的碱性强 |
| D.原子半径:Na>Si>O |
下列说法正确的是
A.H与D,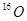 与 与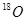 互为同位素: 互为同位素: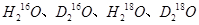 互为同素异形体 互为同素异形体 |
| B.元素X含氧酸的酸性强于元素Y的含氧酸的酸性,则X的得电子能力强于元素Y |
| C.质量数相同的不同核素,一定属于不同种元素 |
D.常温下,在pH=1的溶液中,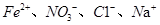 能够大量共存 能够大量共存 |
下表为六种短周期元素的部分性质。
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.37 | 0.74 | 0.75 | 0.82 | 0.99 | 1.10 |
| 主要化合价 | +1 | -2 | +5、-3 | +3 | +7、-1 | +5、-3 |
下列有关说法正确的是
A.元素X、Y、Z形成的化合物一定是离子化合物
B.元素R的氧化物对应水化物一定为强酸
C.化合物QR3分子中各原子均满足8电子稳定结构
D.元素Z的简单气态氢化物的热稳定性比元素T的稳定
现代医学证明,硒是人体中14种必需的营养元素之一,缺硒与贫血、冠心病、不孕症、癌症等疾病直接相关。因此,硒被誉为“生命的奇效元素”。已知硒元素与氧元素同主族,则下列关于硒的叙述中不正确的是( )
| A.H2Se比H2O稳定 |
| B.最高价氧化物的水化物化学式为H2SeO4 |
| C.它有两种氧化物SeO2和SeO3 |
| D.其单质常温下呈固态 |