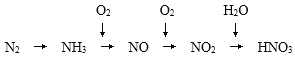题目内容
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,B与C能层数相同,D与E能层数相同,C与D价电子结构相同,基态时B、C、D原子核外皆有2个未成对电子,A、E只有1个未成对电子,A能分别与B、C、D、E形成不同的分子。
(1)写出基态时B的价电子排布图 ,E—的原子结构示意图 。
(2)写出BCD的电子式 ,E2C的结构式 。
(3)根据题目要求完成以下填空:
EC3—中心原子杂化方式 ;DC3中心原子杂化方式 ;
EC4—微粒中的键角 ;BC32—微粒的键角 ;
DE2分子的立体构型 ;B2A2分子的立体构型 。
(4)一种由A、B、C三种元素组成的分子A2BC2,该分子中σ键数目为 ,π键数目为 。
(5)根据等电子原理,指出与BC2互为等电子体的离子 (一种即可)
【答案】(14分)
(1) 2s 2p
↑↓ | ↑ | ↑ |
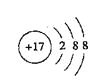
(2)![]() Cl—O—Cl
Cl—O—Cl
(3) sp3sp2109°28ˊ 120° V形 直线形
(4) 4 1
(5)N3- 、AlO2-、 SCN-、CNO- 等任意一种(2分)
【解析】试题分析:A只有1个未成对电子,且A的原子序数在五种元素中最小,B、C是同周期元素,则A是H元素,B、C是第二周期元素,D、E是第三周期元素,E也只有1个未成对电子,结合E的原子序数和周期,判断E是Cl元素;C、D的价电子层结构相同,则C、D是同主族元素,基态时B、C、D原子核外皆有2个未成对电子,B的原子序数小于C,则B的2p能级有2个电子,C的2p能级有4个电子,所以B是C元素,C是O元素,则D是S元素。
(1)根据以上分析B是C元素,价电子排布图为
↑↓ | ↑ | ↑ |
2s 2p
E是Cl元素,Cl-的结构示意图为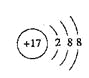
(2)BCD的化学式为COS,根据元素的价键原则,C与O、S分别形成双键,电子式为![]() ;E2C的化学式为Cl2O,所以O分别与Cl原子形成一个共价键,结构式为Cl—O—Cl
;E2C的化学式为Cl2O,所以O分别与Cl原子形成一个共价键,结构式为Cl—O—Cl
(3)根据VSEPR理论,ClO3-的中心原子的价层电子对数=3+1/2(7+1-6)=4,所以中心原子杂化方式是sp3杂化;同理可计算SO3中心原子杂化方式是sp2杂化;ClO4—微粒中的中心原子的杂化方式是sp3杂化,无孤对电子,所以空间构型是正四面体型,键角是109°28ˊ;CO32—微粒的中心原子的杂化方式是sp2杂化,无孤对电子,所以空间构型是平面正三角形,键角是120°;SCl2分子中中心原子的杂化方式是sp3杂化,有2对孤对电子,所以立体构型是V型;C2H2分子中中心原子的杂化方式是sp杂化,立体构型是直线型;
(4)一种由A、B、C三种元素组成的分子A2BC2,化学式为CH2O2,该物质是甲酸,分子中含有4个σ键,1个π键;
(5)与CO2是等电子体的物质的化学式中也是三原子分子,价电子数是16,若为离子则是N3-、AlO2-、 SCN-、CNO- 等。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D