题目内容
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
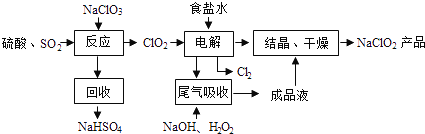
回答下列问题:
(1)NaClO2中Cl的化合价为__________价。
(2)写出“反应”步骤中生成ClO2的化学方程式___________________。
(3)“电解”中阴极反应的主要产物是_________________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2,此吸收反应中,氧化剂与还原剂的物质的量之比为_________, 该反应中氧化产物是___________。
【答案】+32NaClO3+SO2+H2SO4=2NaHSO4+2ClO2NaClO2(或ClO2-)2:1O2
【解析】
(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3价;(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,回收产物为NaHSO4,说明生成硫酸氢钠,且产生ClO2,根据电子守恒可知,此反应的化学方程式为:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2;(3)食盐溶液中混有Mg2+ 和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,ClO2氧化能力强,根据结晶干燥后的产物可知ClO2的还原产物为NaClO2,因此电解装置中阴极ClO2得电子生成ClO2-,阳极Cl-失电子生成Cl2;(4)依据图示可知,利用含过氧化氢的氢氧化钠溶液吸收ClO2,产物为ClO2-,则此反应中ClO2为氧化剂,还原产物为ClO2-,化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2,每摩尔H2O2得到2mol电子,依据电子守恒可知氧化剂和还原剂的物质的量之比为2:1。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |