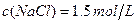题目内容
在氯化铵溶液中撒入镁粉有何现象?并分析其原因。
由于NH4Cl中NH4+离子水解,使溶液呈酸性。镁粉不断与溶液中H+离子反应放出氢气,NH4+水解平衡右移,c(NH3)越来越大,最后NH3挥发,因此挥发出来的气体有刺激性气味。
NH4++H2O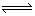 NH3·H2O+H+
NH3·H2O+H+
Mg+2H+=Mg2++H2↑
总的反应方程式是:
2NH4++Mg=2NH3↑+Mg2++H2↑
NH4++H2O
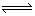 NH3·H2O+H+
NH3·H2O+H+Mg+2H+=Mg2++H2↑
总的反应方程式是:
2NH4++Mg=2NH3↑+Mg2++H2↑
镁是较活泼的金属之一,而氯化镁属易水解的强酸弱碱盐。在溶液中它们之间的反应是水解和置换反应同时存在。
由于NH4Cl中NH4+离子水解,使溶液呈酸性。镁粉不断与溶液中H+离子反应放出氢气,NH4+水解平衡右移,c(NH3)越来越大,最后NH3挥发,因此挥发出来的气体有刺激性气味。
NH4++H2O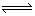 NH3·H2O+H+
NH3·H2O+H+
Mg+2H+=Mg2++H2↑
总的反应方程式是:
2NH4++Mg=2NH3↑+Mg2++H2↑
由于NH4Cl中NH4+离子水解,使溶液呈酸性。镁粉不断与溶液中H+离子反应放出氢气,NH4+水解平衡右移,c(NH3)越来越大,最后NH3挥发,因此挥发出来的气体有刺激性气味。
NH4++H2O
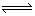 NH3·H2O+H+
NH3·H2O+H+Mg+2H+=Mg2++H2↑
总的反应方程式是:
2NH4++Mg=2NH3↑+Mg2++H2↑

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
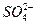 ,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式
,向含a mol KAl(SO4)2的溶液中,逐滴加入Ba(OH)2溶液,过程中可能存在以下多个离子方程式
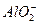 +2H2O
+2H2O 和5.4g Al同时放人一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则
和5.4g Al同时放人一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则