题目内容
12. 用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.
用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示.请回答下列问题:
(1)实验前检查链套装量的气密性的方法是用酒精灯加热烧瓶,当烧杯中的导管口有气泡冒出时,停止加热,若导管口部形成一段水柱,表明整套装置不漏
(2)B中选用的试剂是饱和食盐水,其作用是除去A中产生的气体中含有的HCl气体,C中选用的试剂是浓硫酸,其作用是除去Cl2中混有的水蒸汽.
(3)D中反应的化学方程式是Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2,将此生成物溶于少量水,得到蓝 色溶液.
分析 (1)化学实验装置的气密性检验的原理是使装置内外的压强不相等;
(2)根据浓盐酸的性质及反应方程式确定混合气体的成分,根据氯化氢的性质判断饱和食盐水(或水) 的作用;
(3)铜与氯气在加热条件下生成氯化铜,氯化铜溶于水得到蓝色氯化铜溶液.
解答 解:(1)该装置气密性检验方法:用酒精灯加热烧瓶,当烧杯中的导管口有气泡冒出时,停止加热,若导管口部形成一段水柱,表明整套装置不漏;
故答案为:用酒精灯加热烧瓶,当烧杯中的导管口有气泡冒出时,停止加热,若导管口部形成一段水柱,表明整套装置不漏;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢、水蒸气;氯化氢极易溶于水,氯气的溶解度较小.所以可用盛有饱和食盐水(或水)除去混合气体中的氯化氢;浓硫酸具有吸水性,能够干燥氯气;
故答案为:除去A中产生的气体中含有的HCl气体;浓硫酸,除去Cl2中混有的水蒸汽;
(3)铜与氯气在加热条件下生成氯化铜,化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$ CuCl2;氯化铜溶于水得到蓝色氯化铜溶液;
故答案为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$ CuCl2;蓝.
点评 本题考查了氯气的制备和性质的检验,明确氯气制备原理及各装置作用即可解答,题目难度不大.

练习册系列答案
相关题目
5.常温下对pH<7的溶液的正确说法是( )
| A. | 一定是酸溶液 | B. | 一定是强酸弱碱盐的溶液 | ||
| C. | 一定是酸性溶液 | D. | 一定是能使甲基橙试液变红的溶液 |
6.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 含0.1NA个CO32-的Na2CO3固体的质量为10.6g | |
| B. | 含1mol HCl的盐酸与足量Fe反应,Fe失去的电子总数为2NA | |
| C. | 水的摩尔质量就是NA个水分子的质量之和 | |
| D. | 2mol氦气含有电子数为8NA |
17.下列说法正确的是( )
| A. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,然后涂上稀硼酸溶液 | |
| B. | 过滤、结晶、焰色反应、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| D. | 检验淀粉是否发生水解,可在溶液中滴加新制氢氧化铜悬浊液,加热至沸腾,若有红色沉淀生成说明已水解,反之则没有水解 |
1.卤族元素某种性质(A)随核电荷数的变化趋势如图所示,则A不可能表示( )


| A. | 非金属性 | B. | 氢化物的稳定性 | ||
| C. | 单质熔点 | D. | 最高价氧化物对应水化物酸性 |
2.下列关于二氧化硫和二氧化碳的说法中,正确的是( )
| A. | 二者都可导致温室效应 | B. | 二者都能与Na2CO3溶液反应 | ||
| C. | 二者都既具有氧化性又具有还原性 | D. | 二者都具有漂白性 |

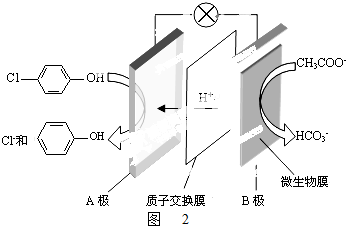
 )的废水可以利用微生物电池除去,其原理如图2所示.
)的废水可以利用微生物电池除去,其原理如图2所示. +Cl-.
+Cl-.