题目内容
17.下列电子式或结构式错误的是( )| A. | OH-的电子式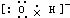 | B. | NH4Br的电子式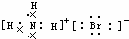 | C. | Na2O的电子式: | D. | Na+的电子式:Na+ |
分析 A、氢氧根离子为阴离子,O原子周围8个电子;
B、溴化铵为离子晶体,由氨根离子与溴离子通过离子键结合在一起;
C、氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
D、金属阳离子电子式即为其阳离子符号.
解答 解:A、氢氧根离子为阴离子,O原子周围8个电子,其电子式为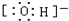 ,故A正确;
,故A正确;
B、溴化铵是离子化合物,由氨根离子与溴离子构成,电子式为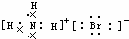 ,故B正确;
,故B正确;
C、氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为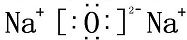 ,故C错误;
,故C错误;
D、钠离子的电子式就是其阳离子符号,为Na+,故D正确,
故选C.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法及区别.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
7.将50mL某AlCl3溶液加入30mL 1mol/L NaOH溶液或50mL 1.8mol/L NaOH溶液中,均能得到0.78g白色沉淀.则此AlCl3溶液的浓度是( )
| A. | 0.5 mol/L | B. | 0.4 mol/L | C. | 0.3 mol/L | D. | 0.2 mol/L |
5.常温下对pH<7的溶液的正确说法是( )
| A. | 一定是酸溶液 | B. | 一定是强酸弱碱盐的溶液 | ||
| C. | 一定是酸性溶液 | D. | 一定是能使甲基橙试液变红的溶液 |
9.溶质的质量分数为a%,溶质的物质的量浓度为c mol/L的硫酸溶液,蒸发溶剂,恢复到原来温度,若溶质的质量分数变为2a,则溶质的物质的量浓度变为( )
| A. | 大于2cmol/L | B. | 小于2cmol/L | ||
| C. | 等于2cmol/L | D. | 在cmol/L和2cmol/L之间 |
6.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 含0.1NA个CO32-的Na2CO3固体的质量为10.6g | |
| B. | 含1mol HCl的盐酸与足量Fe反应,Fe失去的电子总数为2NA | |
| C. | 水的摩尔质量就是NA个水分子的质量之和 | |
| D. | 2mol氦气含有电子数为8NA |
 A,B,C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.
A,B,C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族. .NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.
.NH3分子中N原子的杂化方式为sp3杂化,NH3分子的空间立体构型是三角锥形.