题目内容
 右图是某同学在实验室中制取Cl2的装置图:
右图是某同学在实验室中制取Cl2的装置图:(1)该装置中的错误之处有二,分别是:①
使用长颈漏斗
使用长颈漏斗
②缺少石棉网
缺少石棉网
(2)试写出装置A和C中发生反应的离子方程式:
A处:
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
;C处:
| ||
Cl2+2OH-=Cl-+ClO-+2H2O
Cl2+2OH-=Cl-+ClO-+2H2O
.(3)甲、乙两同学分别采用下列两种方案制取Cl2.
甲:用含HCl 146g的浓盐酸与足量的MnO2反应;
乙:用87g MnO2与足量浓盐酸反应.则所得氯气
B
B
(填代号).A.甲比乙多 B.乙比甲多C.一样多D.无法比较.
分析:(1)盐酸易挥发,不能用长颈漏斗,应用分液漏斗盛装浓盐酸,圆底烧瓶不能直接加热,应垫石棉网;
(2)根据所反应反应和反应物的在溶液中存在的形式书写离子方程式;
(3)注意稀盐酸还原性较弱,不能与二氧化锰发生氧化还原反应生成氯气.
(2)根据所反应反应和反应物的在溶液中存在的形式书写离子方程式;
(3)注意稀盐酸还原性较弱,不能与二氧化锰发生氧化还原反应生成氯气.
解答:解:(1)盐酸易挥发,不能用长颈漏斗,应用分液漏斗盛装浓盐酸,圆底烧瓶不能直接加热,应垫石棉网,
故答案为:使用长颈漏斗;缺少石棉网;
(2)A为制备氯气的发生装置,二氧化锰与浓盐酸在加热条件反应生成氯气、氯化锰和水,离子方程式中难溶物和气体应写成化学式,
该反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,C为尾气处理装置,氯气与NaOH反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+2H2O;
(3)发生反应为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
根据方程式可知,
甲:HCl的物质的量为
=4mol,但随着反应的进行,当为稀盐酸时反应停止,生成的氯气的物质的量小于1mol,
乙:MnO2的物质的量为
=1mol,当1molMnO2完全反应时,生成1mol氯气,
所以乙生成氯气多,故答案为:B
故答案为:使用长颈漏斗;缺少石棉网;
(2)A为制备氯气的发生装置,二氧化锰与浓盐酸在加热条件反应生成氯气、氯化锰和水,离子方程式中难溶物和气体应写成化学式,
该反应的离子方程式为MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(3)发生反应为:MnO2+4HCl(浓)
| ||
根据方程式可知,
甲:HCl的物质的量为
| 146g |
| 36.5g/mol |
乙:MnO2的物质的量为
| 87g |
| 87g/mol |
所以乙生成氯气多,故答案为:B
点评:本题考查氯气的制备,题目难度不大,注意氯气的实验室制法以及浓稀盐酸的性质的差异性.

练习册系列答案
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
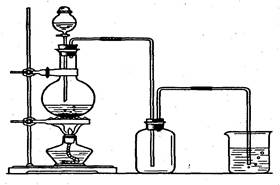
 右图是某同学在实验室中制取Cl2的装置图:
右图是某同学在实验室中制取Cl2的装置图: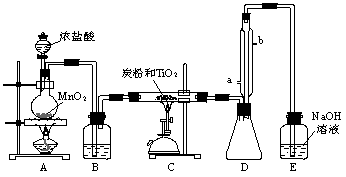 (本题计9分)四氯化钛是无色液体,沸点为136℃,它极易水解,遇空气中的水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。TiCl4可由TiO2与Cl2反应制得(TiO2不与HCl反应)。此反应在1000℃高温下进行的很慢,但如果有炭粉存在时650℃~850℃反应便可顺利进行。右图是某同学设计的实验室制备TiCl4的装置。请回答:
(本题计9分)四氯化钛是无色液体,沸点为136℃,它极易水解,遇空气中的水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。TiCl4可由TiO2与Cl2反应制得(TiO2不与HCl反应)。此反应在1000℃高温下进行的很慢,但如果有炭粉存在时650℃~850℃反应便可顺利进行。右图是某同学设计的实验室制备TiCl4的装置。请回答: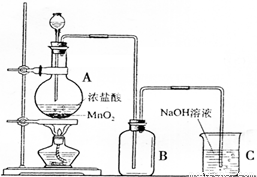 右图是某同学在实验室中制取Cl2的装置图:
右图是某同学在实验室中制取Cl2的装置图: