题目内容
使一定质量的Zn与100mL18.5mol/L的浓硫酸充分反应,Zn完全溶解,同时生成标准状况下的气体A为33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L。求气体A中各组分的体积比
V(SO2)/V(H2)=1/4
设A中SO2、H2的物质的量分别为x、y
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O Zn+H2SO4=ZnSO4+H2↑
_ 2x X y y
则:2x+y=0.1×18.5-1×0.1/2 x+y=33.6/22.4
解得:x=0.3mol y=1.2mol
所以:V(SO2)/V(H2)=1/4
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O Zn+H2SO4=ZnSO4+H2↑
_ 2x X y y
则:2x+y=0.1×18.5-1×0.1/2 x+y=33.6/22.4
解得:x=0.3mol y=1.2mol
所以:V(SO2)/V(H2)=1/4

练习册系列答案
相关题目
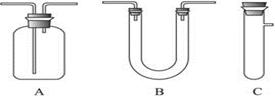
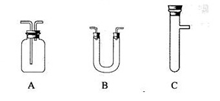
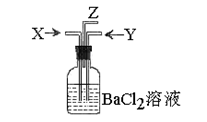
 CO2↑+2H2O+2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
CO2↑+2H2O+2SO2↑请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)