题目内容
【题目】钴的化合物用途广泛。一种利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取CoCl2·6H2O粗品的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110℃~120℃时,失去结晶水生成无水氯化钴。
请回答下列问题:
(1)写出“浸出”时Co2O3发生反应的离子方程式:_______________________。
(2)加入NaClO3的作用是_________________________。
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示。向“滤液Ⅱ”中加入萃取剂的主要目的是_______________,使用萃取剂时最适宜的pH__________(填字母序号)。
A.2.0~2.5 B.3.0~3.5 C.5.0~5.5 D.9.5~9.8

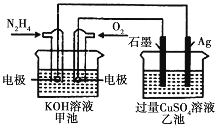
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________。
(5)制得的CoCl2·6H2O粗品经进一步提纯得到CoCl2·6H2O晶体,在烘干晶体时需采用减压烘干,其原因是________________________。
(6)某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6。在电池充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式__________________________________。
【答案】 Co2O3+SO32-+4H+=2Co2++SO42-+2H2O 将Fe2+氧化为Fe3+ 除去Mn2+ B 0.7 降低烘干温度,防止产品分解 Li1-xCoO2+LixC6=LiCoO2+6C
【解析】本题考查化学工艺流程,(1)Co2O3中Co显+3价,浸出液中Co元素显+2价,显然与Na2SO3发生氧化还原反应,反应是Co2O3+SO32-+H+→Co2++SO42-+H2O,根据化合价的升降法进行配平,得到 Co2O3+SO32-+4H+=2Co2++SO42-+2H2O ;(2)NaClO3具有强氧化性,把Fe2+氧化成Fe3+,通过调节pH容易除去Fe3+,因此NaClO3的作用是将Fe2+氧化成Fe3+;(3)根据流程,萃取前已经除去铁元素、钙元素、镁元素,还剩下锰元素,因此萃取的目的是除去Mn2+;最适宜的pH,应是Mn2+萃取率最高的,因此选项B正确;(4) =
=  =
= ![]() =
= ![]() =0.7;(5)加热至110℃~120℃时,失去结晶水生成无水氯化钴,因此减压烘干,可以降低烘干的温度,防止产品分解;(6)充电时电池的负极接电源的负极,阴极反应式是负极反应式的逆过程,因此放电时,负极反应式为LixC6-xe-=xLi++6C,正极反应是得到电子化合价降低,因此正极反应式为:Li1-xCoO2+xLi++xe-=LiCoO2,因此电池反应方程式为: Li1-xCoO2+LixC6=LiCoO2+6C。
=0.7;(5)加热至110℃~120℃时,失去结晶水生成无水氯化钴,因此减压烘干,可以降低烘干的温度,防止产品分解;(6)充电时电池的负极接电源的负极,阴极反应式是负极反应式的逆过程,因此放电时,负极反应式为LixC6-xe-=xLi++6C,正极反应是得到电子化合价降低,因此正极反应式为:Li1-xCoO2+xLi++xe-=LiCoO2,因此电池反应方程式为: Li1-xCoO2+LixC6=LiCoO2+6C。

【题目】下列说法不正确的是( )
A.纯碱是焙制糕点所用的发酵粉的主要成分之一
B.硫酸可用于金属矿石的处理和金属材料的表面清洗
C.还原铁粉可用作食品袋内的抗氧化剂
D.丙三醇俗称甘油,吸湿性强,可用于护肤
【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A. B.
B. C.
C. D.
D.