题目内容
【题目】汽车尾气和燃煤造成空气污染. 
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K= .
向一个10L的密闭容器中充入10mol CO2和7molH2 , 830℃时测得H2为lmol,此时V (正)V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是 .
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2 , 同时消耗1mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2 , 在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)CH3OH (g)
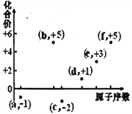
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为
【答案】
(1)![]() ;<;BCE
;<;BCE
(2)0.025mol/(L?s)
(3)c;45%
【解析】解:(1)①反应2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)的化学平衡常数K= ![]() ,所以答案是:
,所以答案是: ![]() ;②向一个10L的密闭容器中充入10mol CO2和7molH2 , 830℃时测得H2为lmol,列三段式:
;②向一个10L的密闭容器中充入10mol CO2和7molH2 , 830℃时测得H2为lmol,列三段式:
2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
c始:1 0.7 0 0
c转:0.2 0.6 0.1 0.3
c(某时刻):0.8 0.1 0.1 0.3
由图表可知830℃时的K=1,则此时的浓度商Qc= ![]() >1,故此时反应向着逆方向进行,V (正)<V (逆);
>1,故此时反应向着逆方向进行,V (正)<V (逆);
所以答案是:<;②A.混合气体的总质量不变,恒容混合气体的体积不变,容器中密度始终不变,故A错误;
B.反应的气体数目发生改变,恒容则压强改变,平衡时,压强保持不变,故B正确;
C.混合气体的总质量不变,混合气体的总的物质的量变小,平均摩尔质量变大,平衡时,保持不变,故C正确;
D.v(CO2):v(H2)=1:3,未说明正逆方向,故D错误;
E.单位时间内消耗2mol CO2 , 说明生成1mol二甲醚,同时消耗1mol二甲醚,说明二甲醚的含量保持不变,化学平衡,故E正确;
F.反应△H不变,故F错误;
所以答案是:BCE;(2)①由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)= ![]() =0.05mol/(Ls),速率之比等于化学计量数之比,故v(N2)=0.5v(CO2)=0.5×0.05mol/(Ls)=0.025mol/(Ls);
=0.05mol/(Ls),速率之比等于化学计量数之比,故v(N2)=0.5v(CO2)=0.5×0.05mol/(Ls)=0.025mol/(Ls);
所以答案是:0.025mol/(Ls);
②接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2 , S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为:  ;
;
所以答案是: 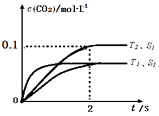 ;(3)①a.升高温度,甲醇的百分含量减小,说明正反应是放热反应,则△H<0,故a错误;
;(3)①a.升高温度,甲醇的百分含量减小,说明正反应是放热反应,则△H<0,故a错误;
b.5min时,b容器中甲醇的含量不一定最高,不一定是平衡状态,则v(正)、v(逆)那样的相等,故b错误;
c.b中的平衡状态转变成c中的平衡状态,甲醇的体积分数减小,说明平衡逆向移动,反应物的化学计量数之和大于生成物的,应是减小压强平衡逆向移动,故c正确;
d.达到平衡时,a、b、c三个容器的反应温度不同,a容器温度最低,c容器的反应温度最高,根据反应放热可判断出,升高温度,平衡逆向移动,甲醇的体积分数减小,故应为a>b>c,故d错误;
所以答案是:c;
②温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,15min,压强比(P后/P前)=0.80,则反应后气体的物质的量=3mol×0.80=2.40mol,气体减少的物质的量=3mol﹣2.4mol=0.6mol,根据气体减少的物质的量与CO之间的关系式知参加反应的CO的物质的量 ![]() =0.45mol,则CO的转化率为
=0.45mol,则CO的转化率为 ![]() =45%;
=45%;
所以答案是:45%.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡的计算的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案