题目内容
【题目】下列图示与对应的叙述相符合的是
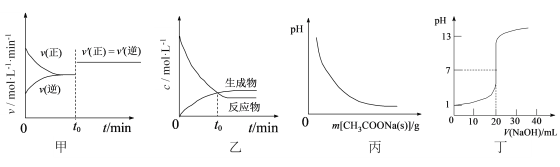
A. 图甲表示已达平衡的反应在t0时刻改变某一条件后,反应速率随时间的变化,则改变的条件可能是缩小容器体积
B. 图乙表示某可逆反应物质的浓度随反应时间的变化,且在t0时刻达到化学平衡状态
C. 图丙表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
D. 图丁表示用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸溶液的滴定曲线
【答案】A
【解析】
根据化学反应原理,分析相关量的变化图象并作出判断。
A项:图甲化学平衡后在t0时刻改变某一条件后,正、逆反应速率都变大但仍相等,可能是气体分子数不变的反应增大压强(缩小容器体积)。A项正确;
B项:图乙可表示可逆反应物质的浓度随反应时间的变化,但t0时刻正反应速率大于逆反应速率,未达化学平衡状态。B项错误;
C项:向CH3COOH溶液中逐步加入CH3COONa固体后,CH3COO-抑制CH3COOH电离,溶液pH随CH3COONa固体的增加而增大,图丙不正确。C项错误;
D项:醋酸为弱酸,20.00 mL 0.1000 mol·L-1醋酸溶液应pH>1。当加入20.00 mL0.1000 mol·L-1NaOH溶液时恰好生成醋酸钠溶液,因CH3COO-水解pH>7。图丁不正确。D项错误。
本题选A。

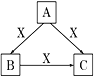
【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物都是形成雾霾天气的重要因素。下列方法可处理氮氧化物和硫氧化物。
(1) 用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,在一定条件下,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=Q kJ/mol。
N2(g)+CO2(g) ΔH=Q kJ/mol。
在T1℃时,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol/L | 0 | 10 | 20 | 30 |
NO | 1.00 | 0.58 | 0.40 | 0.40 |
N2 | 0 | 0.21 | 0.30 | 0.30 |
CO2 | 0 | 0.21 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)=_____________,T1℃时,该反应的平衡常数K= _____________。
②若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2∶1∶1,则Q_____________ (填“>”、“=”或“<”) 0。
(2) NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图甲所示。

①由图甲可知,SCR技术中的氧化剂为_____________。已知 NH3氧化时发生如下反应:
4NH3(g)+5O2(g) = 4NO(g)+6H2O(g) ΔH1=-907.28 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH2=-1811.63kJ·mol-1
则氨气被氧化为氮气和水蒸气的热化学方程式:_______________________
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业选取的最佳催化剂及相应的温度分别为___________、___________。
(3) 烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,若所得溶液呈中性,则该溶液中c(Na+)=__________________(用含硫微粒浓度的代数式表示)。
(4) 某研究小组用NaOH溶液吸收二氧化硫后,将得到的Na2SO3溶液进行电解,其中阴阳膜组合电解装置如图丙所示,电极材料为石墨。

丙
①a表示_______(填“阴”或“阳”)膜。A-E分别代表原料或产品,其中C为稀硫酸,则A为____________溶液(填写化学式)。
②阳极电极反应式为_______________________。