题目内容
【题目】磷酸工业的副产品氟硅酸(H2SiF6)溶液中含少量碘,其回收方案如下。
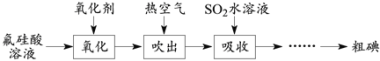
已知:①氟硅酸溶液中碘的可能存在形式为I2、I-、I3-;② I2 + I-![]() I3-。
I3-。
(1)K2Cr2O7、H2O2、NaClO和NaNO2都能使I-氧化为I2。NaNO2在氧化I-时会产生NO,该反应的离子方程式为____。从减少对环境污染的角度,上述氧化剂中可选用的有H2O2、____。
(2)生成的I2可用热空气吹出的原因是____。
(3)在吸收时采用气-液逆流接触,则从吸收装置底部通入的是____(填“吸收液”或“含碘空气”)。吸收后的溶液需反复多次循环吸收含碘空气,其作用是:①提高SO2的利用率;②____。
(4)请补充完整证明氟硅酸溶液中存在I![]() 的实验步骤:取样品,____,取上层液体,重复上述操作2-3次,____。(可选用的试剂:5% 淀粉溶液、0.1 mol·L-1 NaNO2溶液,0.1 mol·L-1 Na2SO3溶液、6 mol·L-1 H2SO4溶液、CCl4)。
的实验步骤:取样品,____,取上层液体,重复上述操作2-3次,____。(可选用的试剂:5% 淀粉溶液、0.1 mol·L-1 NaNO2溶液,0.1 mol·L-1 Na2SO3溶液、6 mol·L-1 H2SO4溶液、CCl4)。
【答案】4H++2NO2-+2I- = I2 + 2NO↑+2H2O NaClO I2受热易升华(或挥发) 含碘空气 增加吸收后溶液中I-浓度 加入CCl4振荡,静置,分液(或加CCl4萃取),有机层呈紫色(或加入5%淀粉溶液变蓝,再加入CCl4萃取) 取上层水溶液滴入5%淀粉溶液不变蓝,再分别滴加6mol·L-1 H2SO4溶液、0.1mol·L-1 NaNO2溶液,变蓝,证明存在I3-。
【解析】
利用碘及其化合物的氧化性、还原性,结合题目给出的信息,分析解答从含碘副产品提取粗碘的问题。
(1)NaNO2将I-氧化为I2,本身被还原成NO。“氧化”发生在酸性溶液(氟硅酸溶液)中,可用H+、H2O配平。该反应的离子方程式为4H++2NO2-+2I- = I2 + 2NO↑+2H2O。酸性溶液中,K2Cr2O7、H2O2、NaClO和NaNO2的还原产物分别是Cr3+、H2O、Cl-和NO,其中K2Cr2O7、Cr3+、NaNO2、NO会污染环境。故要减少污染,可选用H2O2、NaClO。
(2) I2受热易升华,故可用热空气吹出。
(3)“吸收”时发生反应I2 + SO2+2H2O=2HI+H2SO4。用“SO2水溶液”吸收“含碘空气”中的碘,应使气-液逆流充分接触,故吸收液(SO2水溶液)从吸收装置顶部喷下,“含碘空气”从吸收装置底部通入;从反应方程式可知,吸收液(SO2水溶液)反复多次循环吸收含碘空气,可提高SO2的利用率、增加溶液中I-浓度。
(4)据已知② I2 + I-![]() I3-,要证明氟硅酸溶液中存在I
I3-,要证明氟硅酸溶液中存在I![]() ,可证明该溶液中同时存在I2、I-。从“可选用的试剂”看,I2可直接用5% 淀粉溶液检验,或加CCl4萃取后下层呈紫色检验;I-需氧化为I2(0.1 mol·L-1 NaNO2溶液、6 mol·L-1 H2SO4溶液),再用5% 淀粉溶液检验。氟硅酸溶液中原有的I2会干扰I-检验,应当先用CCl4多次萃取分液除去。一种可能的方案:取少量氟硅酸溶液,加入CCl4振荡、静置,下层呈紫色,证明有I2。分液后取上层液体,重复上述操作,直至滴入5%淀粉溶液不变蓝,证明I2已完全除去。再滴加6mol·L-1 H2SO4溶液、0.1mol·L-1 NaNO2溶液,若变蓝,证明有I-。故原氟硅酸溶液中存在I3-。
,可证明该溶液中同时存在I2、I-。从“可选用的试剂”看,I2可直接用5% 淀粉溶液检验,或加CCl4萃取后下层呈紫色检验;I-需氧化为I2(0.1 mol·L-1 NaNO2溶液、6 mol·L-1 H2SO4溶液),再用5% 淀粉溶液检验。氟硅酸溶液中原有的I2会干扰I-检验,应当先用CCl4多次萃取分液除去。一种可能的方案:取少量氟硅酸溶液,加入CCl4振荡、静置,下层呈紫色,证明有I2。分液后取上层液体,重复上述操作,直至滴入5%淀粉溶液不变蓝,证明I2已完全除去。再滴加6mol·L-1 H2SO4溶液、0.1mol·L-1 NaNO2溶液,若变蓝,证明有I-。故原氟硅酸溶液中存在I3-。

【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4